

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a. PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b. Có \(n_{Mg}=\frac{3,6}{24}=0,15mol\)
\(140ml=0,14l\)
\(n_{H_2SO_4}=0,14.1,2=0,168mol\)
Lập tỉ lệ \(\frac{n_{Mg}}{1}< \frac{n_{H_2SO_4}}{1}\)
Vậy Mg đủ, \(H_2SO_4\) dư
Theo phương trình \(n_{H_2SO_4}=n_{Mg}=0,15mol\)
\(\rightarrow n_{H_2SO_4\left(\text{(dư)}\right)}=0,168-0,15=0,018mol\)
\(\rightarrow m_{H_2SO_4\left(\text{(dư)}\right)}n.M=0,018.98=1,764g\)
c. MgSO\(_4\) là muối
Theo phương trình \(n_{MgSO_4}=n_{Mg}=0,15mol\)
\(\rightarrow m_{\text{muối}}=m_{MgSO_4}=n.M=0,15.120=18g\)
d. \(H_2\) là khí
Theo phương trình \(n_{H_2}=n_{Mg}=0,15mol\)
\(\rightarrow V_{H_2\left(ĐKTC\right)}=n.22,4=0,15.22,4=3,36l\)

Gọi a là số mol của lá nhôm tham gia p/ứ:
PTHH:
2Al + 3 CuSO4 \(\rightarrow\)Al(SO4)3 + 3 Cu
a mol\(\rightarrow\)\(\frac{3}{2}\)a mol \(\rightarrow\) \(\frac{3}{2}\)a mol
Theo đề bài cho độ tăng KL của lá nhôm sau p/ứ là:
mCu bám - mal tan = \(\frac{3}{2}\)62a - 27a= 1,38
\(\Rightarrow\)a= 0,02 mol
a) Khối lượng nhôm tham gia phản ứng:
m= n x M = 0,02 x 27 = 0,54 g
b) Khối lượng đồng sunfat trong dung dịch
m = n x M = \(\frac{3}{2}\)0,02 x 160= 4,8 g

gọi a là số mol của kẽm tham gia phản ứng:
PTHH: Zn+ CuSO4 \(\rightarrow\)ZnSO4 + Cu
a mol\(\rightarrow\)a mol \(\rightarrow\) a mol
theo đề bài cho độ giảm khối lượng của bản kẽm sau phản ứng là:
mZn tan - mCu bám = 65a- 64a = 50 - 49,81 = 0,18 ( mol)
a) khối lượng của kẽm tham gia phản ứng:
m= n x M = 0,18 x 65 = 11,7 (g)
b) Khối lượng của CuSO4 là
m= n x m = 0,18 x 160 = 28,8 g

Bài 1 :
nFe = 0,25 mol; nAgNO3 = 0,2 mol; nCu(NO3)2 = 0,05 mol.
Giữa Ag+ và Cu2+ thì Ag+ có tính oxi hóa mạnh hơn Cu2+, nên Ag+ tham gia phản ứng với Fe trước, sau khi Ag+ tham gia phản ứng hết nếu còn dư Fe thì Cu2+ mới tiếp tục tham gia.
Fe + 2Ag+ → Fe2+ + 2Ag (VII)
nFe = 0,25 mol; nAg+ = 0,2 mol → Fe dư sau phản ứng (VII)
Fe + 2Ag+ → Fe2+ +2Ag
0,1 (mol) 0,2 (mol) 0,1 (mol) 0,2 (mol)
Sau phản ứng (VII) ta có: nFe còn = 0,25 – 0,1 = 0,15 mol, Ag tạo thành = 0,2 mol.
Fe + Cu2+ → Fe2+ + Cu (VIII)
nFe = 0,15 mol; nCu2+ = 0,05 mol → Fe vẫn còn dư sau phản ứng (VIII)
Fe + Cu2+ → Fe2+ + Cu
0,05 (mol) 0,05 (mol) 0,05 (mol) 0,05 (mol)
Vậy, sau phản ứng (VII) và (VIII), chất rắn thu được gồm nAg = 0,2 mol; nCu = 0,05 mol và nFe dư = 0,25 – (0,1 + 0,05) = 0,1 mol.
Nên ta có giá trị của m = mAg + mCu + mFe dư
= 0,2.108 + 0,05.64 + 0,1.56 = 30,4 gam.
Bài 2 :
Nhận xét :
- Mg sẽ tác dụng với AgNO3 trước, sau khi AgNO3 hết thì Mg mới phản ứng với Cu(NO3)2.
- Vì chưa biết khối lượng Mg tham gia là bao nhiêu, nên bài toán này ta phải chia ra các trường hợp:
+ Mg tham gia vừa đủ với AgNO3, Cu(NO3)2 chưa tham gia, chất rắn thu được là Ag tính được giá trị m1.
+ AgNO3, Cu(NO3)2 tham gia hết, Mg phản ứng vừa đủ, chất rắn tham gia gồm Ag, Cu có giá trị là m2.
Nếu khối lượng chất rắn trong 2 trường hợp nằm trong khoảng m1< 17,2 < m2 (từ dữ kiện đề bài, tính toán giá trị m1, m2) có nghĩa là Ag+ tham gia phản ứng hết, Cu2+ tham gia một phần.
Đáp số : m = 3,6gam.

khối lượng thanh kim loại giảm -> nguyển tử khối của KL phải lớn hơn Cu và đứng trước Cu trong dãy điện hóa
khối lượng thanh kim loại tăng -> nguyển tử khối của KL phải nhỏ hơn Ag
=> KL cần tìm là Zn

PTHH: K2CO3 + 2 HCl ->2 KCl + H2O + CO2
x___________2x______2x____________x(mol)
KHCO3 + HCl -> KCl + H2O + CO2
y____y__________y_______y(mol)
mHCl= 27,375.0,2= 5,475
Ta có hpt:
\(\left\{{}\begin{matrix}2.36,5x+36,5y=5,475\\22,4x+22,4y=2,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\x=0,05\left(mol\right)\end{matrix}\right.\)
mK2CO3= 0,05.138= 6,9(g)
mKHCO3= 0,05.100=5(g)
=> %mK2CO3= (6,9/11,9).100=57,893%
=> %mKHCO3= 100%- 57,893%= 42,107%
c) mKCl= 0,15. 74,5=11,175(g)
mddKCl= mhh+ mddHCl - mCO2= 11,9+27,375- 0,1.44=34,875(g)
=> C%ddKCl = (11,175/34,875).100=32,043%

nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
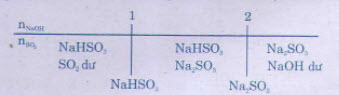
Bài 7*. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thề tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải:
nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) * Hướng dẫn: Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:


TN1: A tác dụng với nước
Ba +2 H2O --> Ba(OH)2 + H2;
x ------------------x------------x ;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
2x--------x---------------------------------------3x;
TN2 : A tác dụng với dd xút
Ba +2 H2O --> Ba(OH)2 + H2;
x----------------------------------x;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
y-------------------------------------------------3/2y;
TN3: A tác dụng với HCl
Ba + 2HCl --> BaCl2 + H2;
x------------------------------x;
2Al + 6HCl --> 2AlCl3 + 3H2;
y------------------------------3/2y;
Mg + 2HCl --> MgCl2 + H2;
z------------------------------z;
Gọi x,y,z lần lượt là số mol của Ba, Al, Mg.
TN1: nH2= 3,36/22,4= 0,15 (mol)
=>x + 3x= 4x=0,15 => x= 0,0375 (mol)
TN2: nH2= 0,3 (mol)
=> x + 3/2 y = 0,3 => y = 0,175 (mol)
TN3: nH2= 0,4 (mol)
=> x +3/2y + z = 0,4 => Z= 0,1 (mol)
m= 0,0375*137+ 0,175*27+ 0,1*24=26,2625(g).