Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho hh 2 muối tác dụng với H2SO4 loãng
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
RCO3 + H2SO4 → RSO4 + H2O + CO2
Số mol khí CO2 sinh ra: n(CO2 1) = 4,48/22,4 = 0,2mol
Nung chất rắn không tan sau pư thấy thoát ra khí CO2 → muối cacbonat dư → H2SO4 đã tham gia phản ứng hết.
Số mol H2SO4 đã dùng: n(H2SO4) = n(CO2) = 0,2mol
Nồng độ dung dịch H2SO4: C(H2SO4) = 0,2/0,5 = 0,4M
b./ Theo ĐL bảo toàn khối lượng:
m(hh muối) + m(H2SO4) = m(muối khan) + m(B) + m(CO2) + m(H2O)
→ m(B) = m(hh muối) + m(H2SO4) - m(muối khan) - m(CO2) - m(H2O) = 115,3 + 0,2.98 - 12.2 - 0,2.44 - 0,2.18 = 110,3g
c./ Số mol CO2 thu được khi nung B: n(CO2 2) = 11,2/22,4 = 0,5mol
Tổng số mol hai muối:
n(hh muối) = n(MgCO3) + n(RCO3) = n(CO2 1) + n(CO2 2) = 0,2 + 0,5 = 0,7mol
n(RCO3) = 2,5.n(MgCO3) → n(MgCO3) = 0,2mol và n(RCO3) = 0,5mol
Khối lượng mỗi muối:
m(MgCO3) = 84.0,2 = 16,8g
m(RCO3) = m(hh muối) - m(MgCO3) = 115,3 - 16,8 = 98,5g
Khối lượng mol phân tử của muối cacbonat cần tìm:
M(RCO3) = R + 60 = m(RCO3)/n(RCO3) = 98,5/0,5 = 197
→ R = 137
Vậy kim loại cần tìm là Ba.

\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Chất rắn không tan : Cu
\(m_{Cu}=3.2\left(g\right)\Rightarrow m_{Fe}=8-3.2=4.8\left(g\right)\)
\(\%Fe=\dfrac{4.8}{8}\cdot100\%=60\%\)
\(\%Cu=100\%-60\%=40\%\)

Còn 2,8g cran → Cu dư =2,8g → Fe và Cu pư với HNO3 hết 9,2g
Vì NO là sản phẩm khử duy nhất → mol H+=4mol NO →mol NO= 0,1,
Áp dụng bt KL và bt E cho pư Fe,Cu ta có :\(\begin{cases}56x+64y=9,2\\2x+2y=0,3\end{cases}\)→mol Fe: 0,05 và mol Cu pư=0,1
Cr thu đk sau khi nung :FeO và CuO tính đk mg=11,6

Đáp án D
Vì D chỉ chứa 2 muối nên D chứa Al(NO3)3 và Zn(NO3)2.
Mà ngâm E trong dung dịch H2SO4 loãng không giải phóng khí nên E chứa Cu và Ag.
Do đó các chất đều phản ứng vừa đủ.
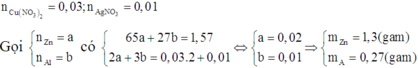

a) Gọi số mol Fe, Cr là a, b (mol)
=> 56a + 52b = 10,8 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a---->a------------------->a
Cr + H2SO4 --> CrSO4 + H2
b--->b------------------->b
=> a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Fe=\dfrac{0,1.56}{10,8}.100\%=51,85\%\\\%Cr=\dfrac{0,1.52}{10,8}.100\%=48,15\%\end{matrix}\right.\)
b) \(n_{H_2SO_4}=a+b=0,2\left(mol\right)\)
=> \(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

nH2=0,4/2=0,2
a. Fe+H2SO4\(\rightarrow\)FeSO4+H2
nFe=nH2=0,2
\(\rightarrow\)%mFe=\(\frac{0,2.56}{12}\)=93,33%
\(\rightarrow\)%mCu=6,67%
b. \(\text{mCu=12-0,2.56=0,8}\)
Khối lượng ddB: \(\text{m=12+200-mH2-mCu=210,8}\)
a) Fe+H2SO4--->FeSO4+H2
Chất rắn A là Cu, B là FeSO4
n H2=04/2=0,2(mol)
Theo pthh
n Fe=n H2=0,2(mol)
m Fe=56/0,2=11,2(g)
m Cu=12-11,2=0,8(g)
b) m dd B =m Fe+m dd H2SO4-m H2
=11,2+200-0,4=210,8(g)