Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Na}=\dfrac{4.6}{23}=0.2\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(0.2......................0.2.......0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
Dung dịch X : NaOH
\(m_{dd_X}=4.6+200-0.1\cdot2=204.4\left(g\right)\)
\(C\%_{NaOH}=\dfrac{0.2\cdot40}{204.4}\cdot100\%=3.9\%\%\)

\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05
b) \(n_{H2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
c) \(n_{HCl}=\dfrac{0,05.2}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

\($a/$\\ Zn+2HCl \to ZnCl_2+H_2\\ b/\\ n_{Zn}=0,1(mol)\\ n_{HCl}=0,1.2=0,2(mol)\\ m_{ddHCl}=\frac{0,2.36,5.100}{7,3}=100(g)\\ C\%_{ZnCl_2}=\frac{0,1.136}{100+6,5-0,1.2}.100\%=12,8\%\)
\(a/\\ Zn+2HCl \to ZnCl_2+H_2\\ b/\\ n_{Zn}=\frac{6,5}{65}=0,1(mol)\\ n_{HCl}=0,2(mol)\\ m_{ddsaupu}=\frac{0,1.36,5.100}{7,3}+6,5-0,1.2=56,3(g)\\ C\%_{ZnCl_2}=\frac{0,1.136}{56,3}.100\%=24,16\%\)

a) Các chất td được với dd HCl: MgO, KOH, Na, MgSO4, Fe
Pt: MgO + 2HCl --> MgCl2 + H2O
.....KOH + HCl --> KCl + H2O
....2Na + 2HCl --> 2NaCl + H2
.....MgSO4 + 2HCl --> MgCl2 + H2SO4
.....Fe + 2HCl --> FeCl2 + H2
b) Các chất td được với CuSO4: Na, BaCl2, Fe
Pt: 2Na + 2H2O --> 2NaOH + H2
......CuSO4 + 2NaOH --> Cu(OH)2 + Na2SO4
......BaCl2 + CuSO4 --> BaSO4 + CuCl2
......Fe + CuSO4 --> FeSO4 + Cu
c) Các chất td được với NaOH: HCl, CO2, MgSO4
Pt: NaOH + HCl --> NaCl + H2O
.....\(\left\{{}\begin{matrix}CO_2+NaOH\rightarrow NaHCO_3\\CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\end{matrix}\right.\)
......MgSO4 + 2NaOH --> Mg(OH)2 + Na2SO4
a)MgO+2HCl--->MgCl2+H2
KOH+HCl--->KCl+H2O
2Na+2HCl--->2NaCl+H2
Fe+2HCl--->FeCl2+H2
b)2Na+2H2O--->2NaOH+H2
2NaOH+CuSO4--->Na2SO4+Cu(OH)2
BaCl2+CuSO4--->BaSO4+CuCl2
Fe+CuSO4--->FeSO4+Cu
c)HCl+NaOH--->NaCl+H2O
CO2+2NaOH--->Na2CO3+H2O
CO2+NaOH--->NaHCO3
MgSO4+2NaOH--->Na2SO4+Mg(OH)2

\(PTHH:CuO+H_2\rightarrow Cu+H_2O\)
\(n_{CuO}=\dfrac{m}{M}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
→ Sau phản ứng CuO dư, H2 hết
→ Theo \(n_{H_2}\)
Theo PTHH: \(n_{Cu}=n_{H_2}=0,1\left(mol\right)\)
⇒ Khối lượng Cu sinh ra là: \(m_{Cu}=0,1.64=6,4\left(g\right)\)
Khối lượng CuO phản ứng là: mCuO phản ứng\(=0,1.80=8\left(g\right)\)
Khối lượng CuO dư là:
mCuO dư = mCuO ban đầu – mCuO phản ứng \(=16-8=8\left(g\right)\)
Khối lượng chất rắn thu được sau phản ứng là:
mchất rắn = mCu sinh ra + mCuO dư \(=6,4+8=14,4\left(g\right)\)
nCuO = 16/80 = 0,2 (mol)
nH2 = 2,24/22,4 = 0,1 (mol)
PTHH: CuO + H2 -> (t°) Cu + H2O
LTL: 0,2 > 0,1 => CuO dư
nCuO (p/ư) = nCu = nH2 = 0,1 (mol)
=> m = (0,2 - 0,1) . 80 + 0,1 . 64 = 12,4 (g)

\(Zn+2HCl->ZnCl_2+H_2\\ Mg+2HCl->MgCl_2+H_2\\ n_{Zn}=a\\ n_{Mg}=b\\ 65a+24b=11,3g\\ n_{H_2}=a+b=\dfrac{6,72}{22,4}=0,3\\ a=0,1\\ m_{Zn}=65.0,1=6,5g\)

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b+c) Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)=n_{FeCl_2}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,2\cdot127=25,4\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\end{matrix}\right.\)
d) Số phân tử H2: \(0,2\cdot6\cdot10^{23}=1,2\cdot10^{23}\left(phân.tử\right)\)
e)
+) Cách 1: Theo PTHH: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\) \(\Rightarrow m_{HCl}=0,4\cdot36,5=14,6\left(g\right)\)
+) Cách 2:
Ta có: \(m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
Bảo toàn khối lượng: \(m_{HCl}=m_{FeCl_2}+m_{H_2}-m_{Fe}=14,6\left(g\right)\)
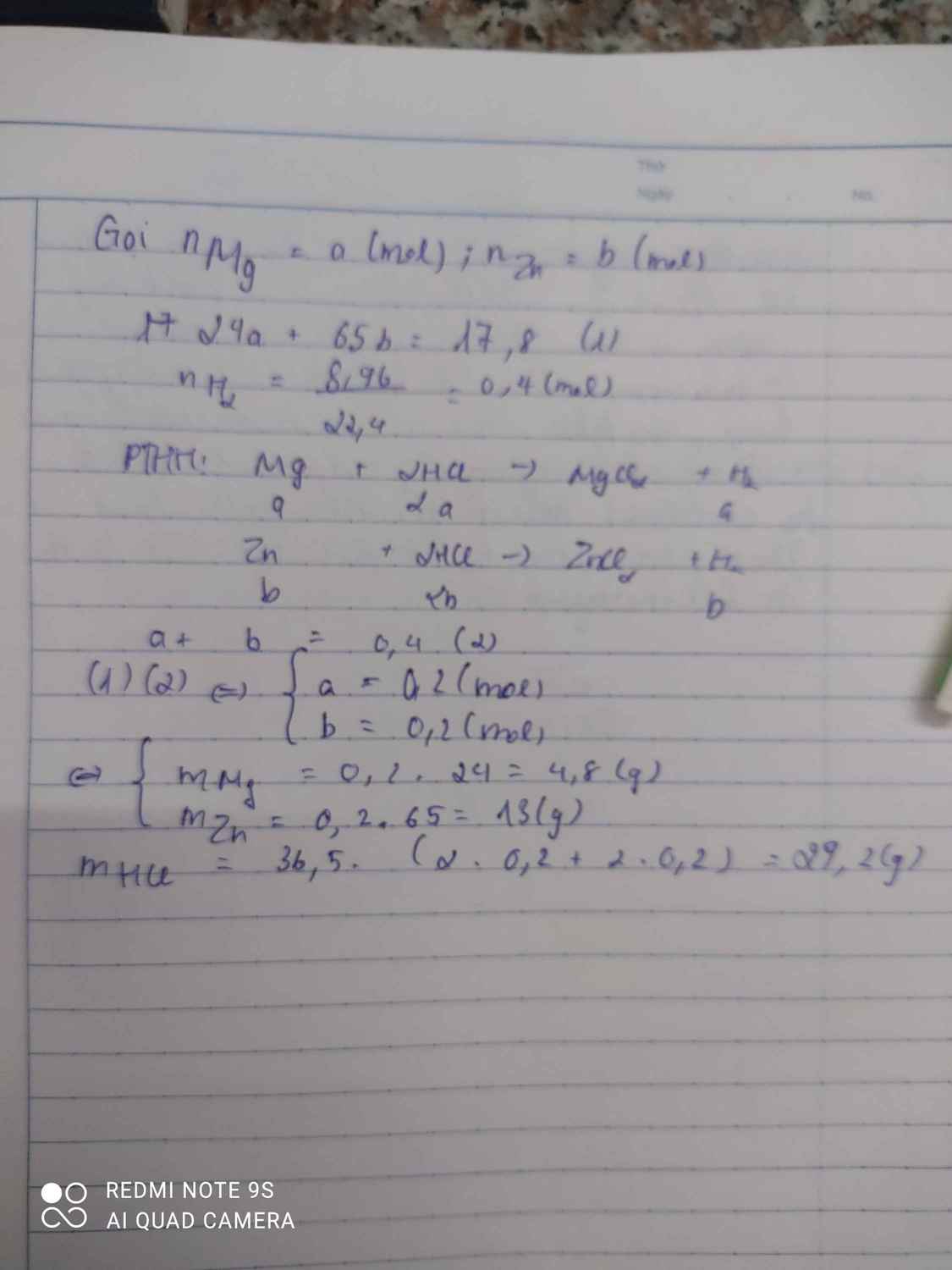
nHCl = 1,12 mol
HCl + KOH \(\rightarrow\) KCl + H2O
1,12......1,12
\(\Rightarrow\) mKOH = 1.12.56 = 62,72 (g)
nHCl = 1.1,12 = 1,12mol
HCl + KOH -> H2O + KCl
1,12...1,12
a = mKOH = 1,12 . 56 = 62,72 g