Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
● Gọi số mol NaOH dùng ở lần 1 là a mol ta có sơ đồ.
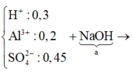
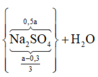
● ⇒ Với nNaOH = (a + 0,45) mol thì nAl(OH)3 = a - 0 , 3 6
+ Ta có sơ đồ:

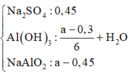
⇒ Ta có nAl(OH)3 = 4nAl(OH)3 – (nNaOH – nH+)
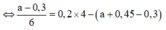
a = 0,6 mol ⇒ VNaOH = 0,6 lít = 600 ml ⇒ Chọn C

Giải thích:
nOH = 0,03 mol và nAl3+ = 0,02mol
Khi cho dung dịch NaOH vào thì
Al3+ + 3OH- → Al(OH)3
Ban đầu : 0,02 mol 0,03 mol
Sau PƯ 0,01 0 0,01 mol
→ mAl(OH)3 = 0,78 g
Đáp án D

Đáp án A
Dung dịch sau phản ứng chắc chắn có chứa các ion K + , Na + , Cl - . Mặt khác, n K + + n Na + > n Cl - , suy ra dung dịch sau phản ứng còn chứa ion âm, đó là Al OH 4 - . Theo bảo toàn điện tích, ta có :

![]()
![]()
= 0,05 mol
![]()
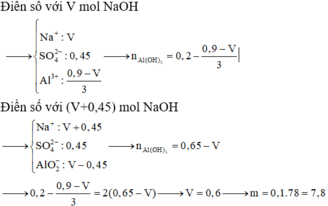
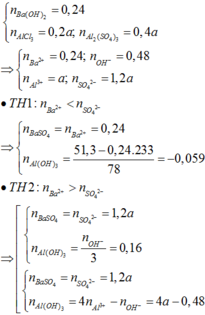


\(n_{Al2\left(SO4\right)3}=0,1\left(mol\right)\)
\(n_{Al\left(OH\right)3}=0,04\left(mol\right)\)
\(V_{max}\Leftrightarrow Al\left(OH\right)_3\) tan một phần
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
0,1__________0,6__________0,2___________
\(\Rightarrow\) Có 0,2-0,04 =0,16(mol) Al(OH)3 tan
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
0,16_________0,16____________
\(\Sigma n_{NaOH}=0,76\left(mol\right)\)
\(\Rightarrow V=0,76\left(l\right)=760\left(ml\right)\)
Vậy đáp án đúng :D
• 0,01 mol Al2(SO4)3 + V ml NaOH → ↓
Nung ↓ → 0,03 mol Al2O3
→ nAl(OH)3 = 0,03 × 2 = 0,06 mol.
• TH1: NaOH thiếu
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
nNaOH = 3 × nAl(OH)3 = 3 × 0,06 = 0,18 mol → VNaOH = 0,18 : 0,1 = 1,8 lít = 1800ml.
• TH2: NaOH dư
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4(*)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (**)
==> bạn tự làm tiếp nha