Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
nX = 0,4 (mol)
n↓ = nPbS = 0,1 (mol)
Pb(NO3)2 + H2S →PbS + 2HNO3
![]()

\(n_{PbS}=\dfrac{47,8}{239}=0,2\left(mol\right)\)
Bảo toàn S: \(n_{FeS}=n_{H_2S}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<----------------------0,1
=> mFe = 0,1.56 = 5,6 (g)
mFeS = 0,2.88 = 17,6 (g)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+17,6}.100\%=24,138\%\\\%m_{FeS}=\dfrac{17,6}{5,6+17,6}.100\%=75,862\%\end{matrix}\right.\)

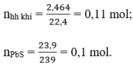
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

Đáp án A
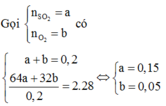
Có: ![]()
Mol trước phản ứng 0,15 0,05
Mol phản ứng 2x x 2x
Mol cân bằng (0,15 – 2x) (0,05 – x) 2x
Do đó

Đáp án A
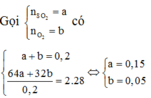
Có: ![]()
Mol trước phản ứng 0,15 0,05
Mol phản ứng 2x x 2x
Mol cân bằng (0,15 – 2x) (0,05 – x) 2x
Do đó
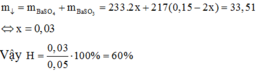
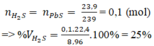
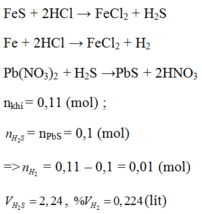
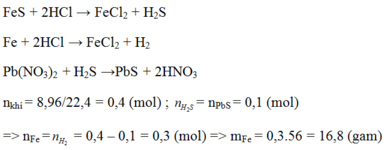
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol CaCO3 = 1_100=0,01 mol
Bài toán này có thể là 1 trong 2 trường hợp sau:
TH1: Số mol CO2 không đủ tác dụng với số mol Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Số mol CO2 = số mol CaCO3 =0,01 mol
=>Thể tích CO2 = 22,4.0,01=0,224 lít
Vậy %thể tích CO2 = (0,224.100)/10=2,24%
TH2: Số mol CO2 nhiều hơn số mol Ca(OH)2 tham gia phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Theo (1): số mol CO2 (1) = số mol CaCO3 = Số mol Ca(OH)2 = 0,04 mol
Ta có: Số mol CaCO3 (2) = 0,04-0,01 = 0,03 (mol)
Theo (2): Số mol CO2(2) = số mol CaCO3 (2) = 0,03 (mol)
Vậy tổng số mol CO2 phản ứng (1) và (2) là 0,04 + 0,03 = 0,07 mol
Do đó %thể tích CO2 = (0,07.22,4.100)/10 = 15,68%