Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Vì hai kim loại X, Y đều có hóa trị không đổi và khối lượng hai phần bằng nhau nên ở hai phần, số mol electron mà kim loại nhường bằng nhau.
Khi đó
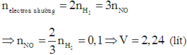

\(n_{SO_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: \(2Al+6H_2SO_4\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Mg+2H_2SO_4\underrightarrow{t^o}MgSO_4+SO_2+2H_2O\)
Đặt \(n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27a+24b=7,65\\1,5a+b=0,375\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{27.0,15}{7,65}.100\%=52,94\%\\ \%m_{Mg}=100\%-52,94\%=47,06\%\)

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A

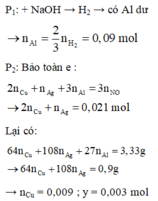
Trong 6,66g B có : 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe
Đáp án A

Đáp án C
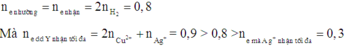
Do đó Ag+ phản ứng hết, Cu2+ phản ứng một phần và còn dư.
Khi đó Al và Zn đều phản ứng hết.
Suy ra Z chứa Cu và Ag.


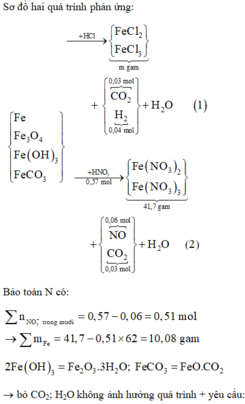
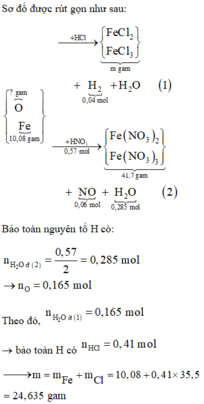
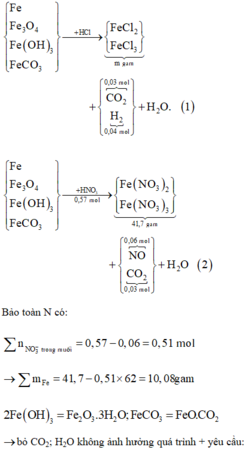
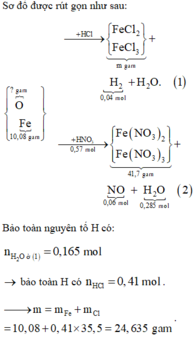
Al Al3+ + 3e
Mg Mg2+ + 2e
Zn Zn2+ + 2e
2H++2e H2
O2 + 4e 2O2-
Phần 1 : Số mol nHCl = 2nH2 = 0,065.2=0,13
Khối lượng Clo có trong muối là : m = 0,13 . 35,5=4,615 g
Khối lượng muối thu được ở phẩn 1 là : a =1,145 + 4,615 =5,76 g
ne kim loại nhường = ne Hidro nhận = n e oxi nhận = 0,13 mol
Suy ra số mol oxi = = 0,0325
Vậy khối lượng oxit b = m kim loại + m oxi =2,185 gam