Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Trích một ít các chất làm mẫu thử
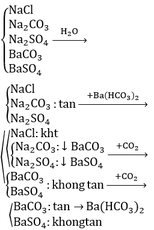
- Hòa tan các chất rắn vào cốc đựng H2O dư:
+ Chất rắn tan: Na2CO3, NaCl, Na2SO4 (1)
+ Chất rắn không tan: BaCO3, BaSO4 (2)
- Dẫn khí CO2 dư vào 2 cốc ở (2):
+ Chất rắn tan: BaCO3
\(BaCO_3+CO_2+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
+ Không hiện tượng: BaSO4
- Dẫn khí CO2 dư qua cốc nước chứa BaCO3, thu được dd Ba(HCO3)2. Cho các dd ở (1) tác dụng với dd Ba(HCO3)2, sau đó dẫn khí CO2 dư qua cốc xuất hiện kết tủa:
+ Không hiện tượng: NaCl
+ Xuất hiện kết tủa trắng, khi dẫn CO2 vào thì kết tủa tan dần: Na2CO3
\(Na_2CO_3+Ba\left(HCO_3\right)_2\rightarrow BaCO_3\downarrow+2NaHCO_3\)
\(BaCO_3+CO_2+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
+ Xuất hiện kết tủa trắng, khi dẫn CO2 vào thì không có hiện tượng xảy ra: Na2SO4
\(Na_2SO_4+Ba\left(HCO_3\right)_2\rightarrow BaSO_4\downarrow+2NaHCO_3\)

B1: Cho H2O vào thì sẽ thấy BaCO3 và BaSO4 k tan còn 3 muối Na đều tan.
B2: Sục CO2 vào 2 lọ đựng BaCO3 và BaSO 4 , nếu lọ nào thấy kết tủa tan thì đó là lọ đựng BaCO3 còn lọ đựng BaSO4 k có hiện tượng j cả
BaCO3 + CO2 +H2O ----------> Ba(HCO3)2
B3:Cho Ba(HCO3)2 vừa tạo ra vào 3 lọ muối Na
* Lọ nào k phản ứng là lọ đựng NaCl
* LỌ nào tạo ra kết tủa là Na2CO3 và Na2SO4
Na2CO3 + Ba(HCO3 )2 ----------> NaHCO3 + BaCO3
Na2SO4 + Ba(HCO3)2 -------------> NaHCO3 + BaSO4
B4: Cho sục khí CO2 vào 2 lọ chưa nhận biết dc chất ở B3
* Lọ nào thấy kết tủa tan là lọ đựng BaCO3 hay ban đầu đựng Na2CO3
* Lọ đựng sản phẩm BaSO4 sẽ k có ht gì cả
BaCO3 + CO2 +H2O ----------> Ba(HCO3)2

BaCO3 + CO2 + H2O → Ba(HCO3)2
Na2CO3 + Ba(HCO3)2 → 2NaHCO3 + BaCO3↓
Na2SO4 + Ba(HCO3)2 → 2NaHCO3 + BaSO4↓

- Lấy vài giọt mỗi dung dịch cho vào ống nghiệm làm mẫu thử và đánh số thứ tự tương ứng với từng lọ
- Chọn kim loại sắt làm thuốc thử là tốt nhất
- Dùng kim loại sắt thì nhận ra được dd HCl với hiện tượng : ống nghiệm có sủi bọt khí thoát ra
PTHH : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
- Dùng dd HCl trong lọ vừa nhận ra được , cho td với các dd còn lại thì nhận ra dd Na2CO3 với hiện tượng : có khí thoát ra
PTHH : \(Na2CO3+2HCl\rightarrow 2NaCl+CO2\uparrow+H2O\)
- Dùng dd Na2CO3 trong lọ vừa nhận ra được , cho td với dd còn lại thì nhận ra được Ba(NO3)2 với hiện tượng : Trong ống nghiệm có xuất hiện kết tủa trắng
PTHH : \(Na2CO3+Ba\left(NO3\right)2\rightarrow BaCO3\downarrow+2NaNO3\)
- Dùng dd Ba(NO3)2 trong lọ vừa nhận ra , cho td với dd còn lại thì nhận ra được dd Na2SO4 với hiện tượng : có xuất hiện kết tủa trắng
PTHH : \(Ba\left(NO3\right)2+Na2SO4\rightarrow BaSO4\downarrow+2NaNO3\)

Câu 1 : D
- Mẫu thử nào tạo khí là $K_2CO_3$, không hiện tượng là $K_2SO_4$
$K_2CO_3 + H_2SO_4 \to K_2SO_4 + CO_2 + H_2O$
Câu 2 : C
$CO_2 + NaOH \to NaHCO_3$
$HCl + NaOH \to NaCl + H_2O$
$NaOH + H_2S \to NaHS + H_2O$

Lấy mỗi chất ra một ít và làm thí nghiệm sau:
- Cho dung dịch HCl vào từng mẫu thử:
+ Chất bột tan và có hiện tượng khí không màu thoát ra: `Na_2CO_3`, `MgCO_3` (I)
\(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\)
\(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\)
+ Chất bột tan: `Na_2SO_4`
+ Chất bột không tan: `BaSO_4`
- Đun nóng 2 chất bột ở nhóm (I):
+ Có hiện tượng chất rắn xuất hiện và có khí không màu thoát ra: `MgCO_3`
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
+ Không hiện tượng: `Na_2CO_3`

+Có phân biệt được.
+Lấy mẫu thử và đánh dấu.
+Hòa tan các mẫu thử vào nước, sục tiếp khí CO2 vào:
Ba(NO3)2 + H2O + CO2 \(\rightarrow\) BaCO3 \(\downarrow\) + 2HNO3
+Cho các dd (nhóm I) td với dd Ba(NO3)2 vừa nhận đc
Na2SO4 + Ba(NO3)2 \(\rightarrow\) BaSO4 \(\downarrow\) + 2NaNO3
Na2CO3 + Ba(NO3)2 \(\rightarrow\) BaCO3 \(\downarrow\) + 2NaNO3
+Cho 2 dd còn lại td với dd HCl vừa nhận đc:
Na2CO3 + HCl \(\rightarrow\) NaCl + H2O + CO2 \(\uparrow\)