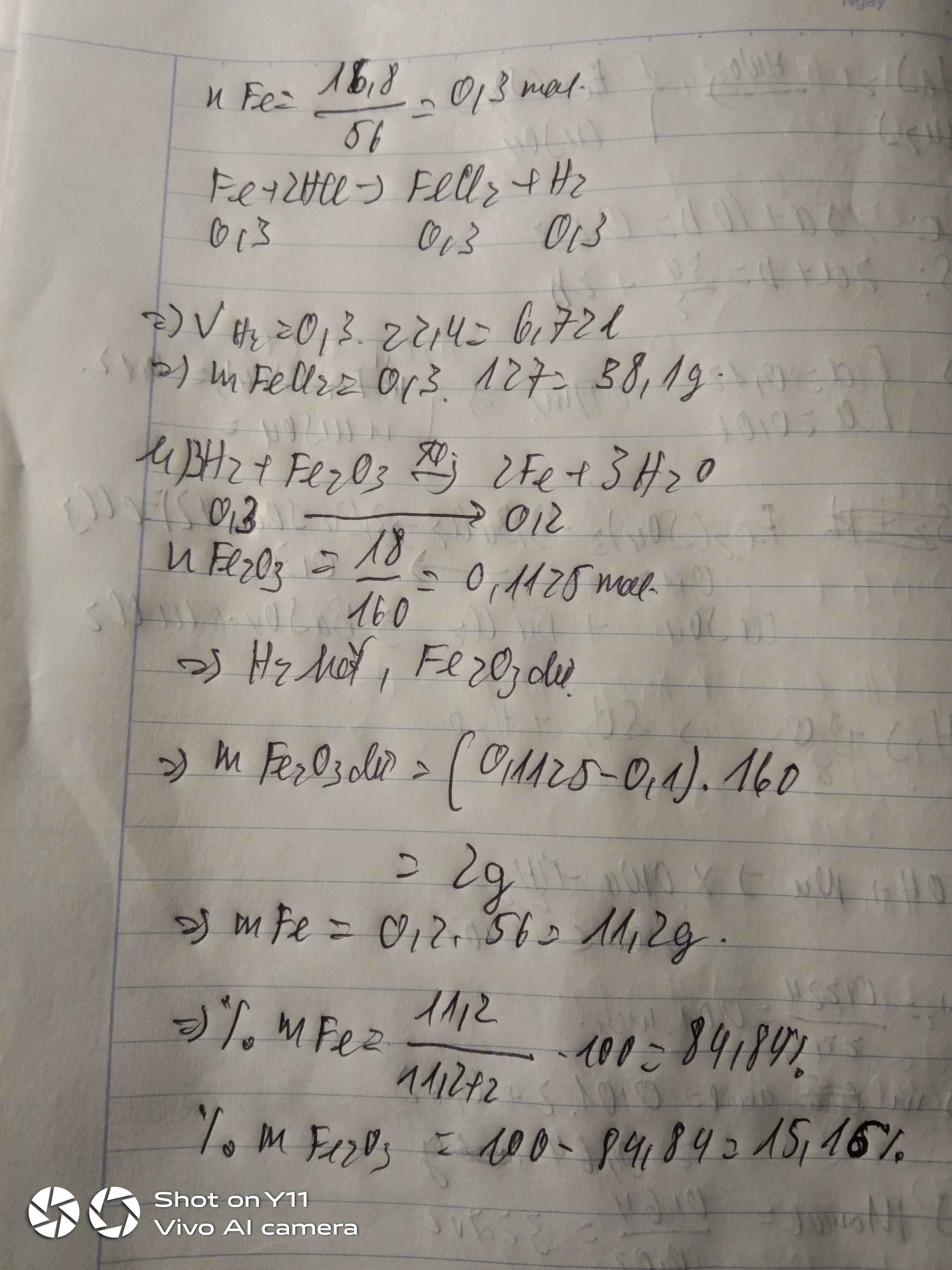Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,1_____0,2______0,1_____0,1 (mol)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
\(m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
b, \(C_{M_{HCl}}=\dfrac{0,2}{0,1}=1\left(M\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{CuO\left(pư\right)}=n_{Cu}=n_{H_2}=0,1\left(mol\right)\Rightarrow n_{CuO\left(dư\right)}=0,05\left(mol\right)\)
⇒ m chất rắn = mCuO (dư) + mCu = 0,05.80 + 0,1.64 = 10,4 (g)

Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.


a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
d, \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{14,6}{7,3\%}=200\left(g\right)\)
⇒ m dd sau pư = 13 + 200 - 0,2.2 = 212,6 (g)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{27,2}{212,6}.100\%\approx12,79\%\)

a)\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,3 0,3 0,3
\(V_{H_2}=0,3\cdot22,4=6,67l\)
\(m_{FeCl_3}=0,3\cdot127=38,1g\)
b)\(n_{Fe_2O_3}=\dfrac{18}{160}=0,1125mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,1125 0,3 0 0
0,1 0,3 0,2 0,3
0,0125 0 0,2 0,3
\(m_{Fe}=0,2\cdot56=11,2g\)

Zn + 2HCl -> ZnCl2 + H2 (1)
nZn=0,1(mol)
Từ 1:
nZnCl2=nH2=nZn=0,1(mol)
mZnCl2=136.0,1=13,6(g)
VH2=0,1.22,4=2,24(lít)
CuO +H2 -> Cu + H2O (2)
Từ 2:
nO=nH2=0,1(mol)
mO=16.0,1=1,6(g)
mchất rắn còn lại=10-1,6=8,4(g)
Chúc Bạn Học Tốt

mFe= 8,4/56= 0,15 mol
m HCl = 14,6/36,5=0,4 mol
PTHH: Fe +2HCl →FeCl2 +H2
Bđ: 0,15 0,4 0 0 mol
Pứ: o,15→0,3 0,15 0,15 mol
Sau pứ:0 0,1 0,15 0,15 mol
a. HCl dư: m =0,1.36,5=3,65 g
b. m FeCl2 = 0,15.127=19,05 g
c. m H2 = 0,15.2= 0,3 g
V H2= 0,15.22,4=3,36 (l)

Zn+2HCl=>ZnCl2+H2
nZn=0,05 mol=nH2
H2+CuO=>Cu+H2O
=>nCu=0,05mol =>mCu=0,05.64=3,2g
Trong pứ trên Zn và H2 là chất khử
HCl và CuO là chất oxh
2. mNaCl thu đc=150.3,5%=5,25g
Cho 13gam Zn tác dụng với dung dịch HCL vừa đủ Dẫn toàn bộ khí thu được qua CuO nung nóng
a, Viết PT hoá học của CÁC phản ứng
b, Tính khối lượng Cu thu được sau phản ứng

\(a,n_{Fe_2O_3}=\dfrac{12,8}{160}=0,08\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,08---->0,24------>0,16
b, VH2 = 0,24.24,79 = 5,9496 (l)
c, mFe = 0,16.56 = 8,96 (g)
\(d,n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
LTL: \(0,16< \dfrac{0,4}{2}\) => HCl dư
Thep pthh: nH2 = nFe = 0,16 (mol)
=> VH2 = 0,16.24,79 = 3,9664 (l)
\(n_{Fe_2O_3}=\dfrac{12,8}{160}=0,08\left(mol\right)\\
pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,08 0,24 0,16
\(V_{H_2}=0,24.22,4=5,376l\\
m_{Fe}=0,16.56=8,96\left(mol\right)\)
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\
pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(LTL:\dfrac{0,16}{1}< \dfrac{0,4}{2}\)
=>HCl dư
\(n_{H_2}=n_{Fe}=0,16\left(mol\right)\\
V_{H_2}=0,16.22,4=3,584l\)