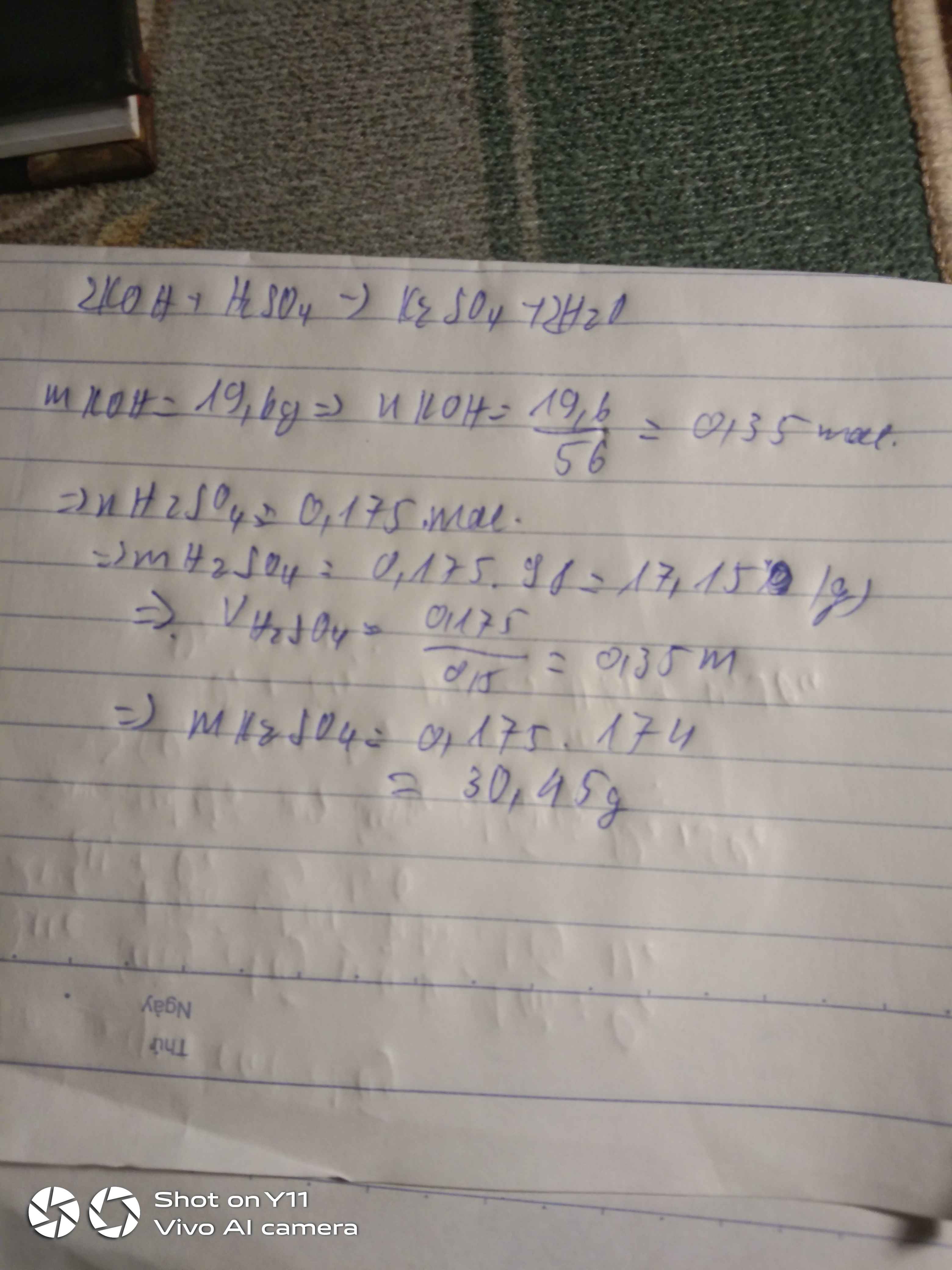Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :
\(n_{KOH}=\dfrac{25\%.112}{100\%.56}=0,5\left(mol\right)\)
Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
\(n_{H2SO4}=\dfrac{1}{2}n_{KOH}=0,25\left(mol\right)\Rightarrow m_{ddH2SO4}=\dfrac{0,25.98}{4,9\%}.100\%=500\left(g\right)\)

\(n_{KOH}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\)(mol)
PTHH : 2KOH + H2SO4 ---> K2SO4 + 2H2O
2 : 1 : 1 : 2
0.2mol 0.1mol
\(m_{H_2SO_4}=n.M=0,1.98=9,8\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{m_{H_2SO_4}.100\%}{C\%}=\dfrac{9,8.100\%}{35\%}=28\left(g\right)\)
\(n_{KOH}=\dfrac{11,2.20}{100.56}=0,04\left(mol\right)\)
PTHH: 2KOH + H2SO4 --> K2SO4 + 2H2O
_____0,04---->0,02
=> mH2SO4 = 0,02.98 = 1,96 (g)
=> \(m_{ddH_2SO_4}=\dfrac{1,96.100}{35}=5,6\left(g\right)\)

C
\(n_{KOH}=\dfrac{11,2.20\%}{56}=0.04mol\)
\(PTHH:2KOH+H_2SO_4->K_2SO_4+2H_2O\)
\(=>m_{H_2SO_4}=98.0,02=1,96\left(g\right)\)
\(=>m_{d^2H_2SO_4}35\%=\dfrac{1.96}{35\%}=5,6g\)

\(n_{OH^-}=n_{KOH}=\dfrac{1,12}{56}=0,02mol\)
Để trung hòa\(\Rightarrow n_{H^+}=n_{OH^-}=0,02mol\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,01mol\Rightarrow m=0,98g\)
\(m_{dd}=\dfrac{0,98}{35}\cdot100=2,8\left(g\right)\)
Chọn C.
có thể cho em hỏi chỗ oh- với oh+ là sao 0 ạ?? em 0 hiểu chỗ đó lắm

a.250ml=0,25l ; nHCl=0,25.1,5=0,375mol
KOH+HCl->KCl+H2O
1mol 1mol 1mol
0,375 0,375 0,375
VKOh=0,375/2=0,1875l
b.CM KCL=0,375/0,25=1,5M
c.NaOH+HCL=NaCl+H2O
1mol 1mol
0,375 0,375
mdd NaOH=0,375.40.100/10=150g