Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D

Chọn D
Gọi số mol Na là x mol → số mol Al là 2x mol. Theo bài ra chất rắn không tan sau phản ứng là Al dư.


Chọn đáp án B
Do thu được rắn không tan ⇒ Al dư. Đặt nNa = x.
⇒ nAl phản ứng = nNaAlO2 = x. Bảo toàn electron:
x + 3x = 2 × 0,4 ⇒ x = 0,2 mol ⇒ m = 27 × (0,2 × 2 - 0,2) = 5,4(g).

Giải thích:
Đặt nNa = x mol, nAl = 2x mol
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + OH- + H2O → AlO2- + 1,5H2
x ← x → 1,5x
=> 0,5x + 1,5x = nH2 = 0,4 => x = 0,2 => m = mAl dư = 27(2x – x) = 5,4 gam
Đáp án D

Giải thích:
Pư 2 có Al dư → nH2 (2 pư) = 2nNa = 0,4 → nNa =0,2 mol
→ nAl =0,4 mol → rắn là 0,2 mol Al → m =5,4 g
Đáp án B

nH2 = \(\dfrac{V_{H^2}}{22,4}\) = \(\dfrac{2,24}{22,4}\) = 0,1 (mol)
n = \(\dfrac{m_{NaAlO_2}}{M_{NaAlO_2}}\) = \(\dfrac{1,35}{82}\) \(\approx\) 0,02 (mol)
Ta có phương trình hoá học:
2NaOH + 2Al + 2H2O \(\underrightarrow{t^0}\) 2NaAlO2 + 3H2
PT: 2 : 2 : 2 : 2 : 3 (mol)
ĐB: \(\dfrac{0,02}{2}\) < \(\dfrac{0,1}{3}\) (mol)
⇒ H2 dư, mọi tính toán dựa vào số mol của NaAlO2
Ta có phương trình hoá học:
2NaOH + 2Al + 2H2O \(\underrightarrow{t^0}\) 2NaAlO2 + 3H2
PT: 2 : 2 : 2 : 2 : 3 (mol)
ĐB: 0,02: 0,02: 0,02 : 0,02 : 0,03 (mol)
mNaOH = nNaOH . MNaOH = 0,02 . 40 = 0,8 (g)
mAl = nAl . MAl = 0,02 . 27 = 0,54 (g)
Vậy mNaOH = 0,8 g, mAl = 0,54 g.
* Chú thích: PT là phương trình, ĐB là đề bài.
Dòng 2 bị thiếu nên đây là dòng 2 được viết lại ạ: \(n_{NaAlO_2}\) = \(\dfrac{m_{NaAlO_2}}{M_{NaAlO_2}}=\dfrac{1,35}{82}\approx0,02\left(mol\right)\)

Gọi số mol Ba ; Na và Al trong X lần lượt là : x ; y ; 6x mol
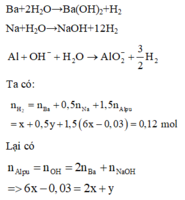
=> x = 0,015 ; y = 0,03 mol
=> m = 0,015.137 + 0,03.23 + 0,015.6.27 = 5,175g
Đáp án C
Gọi số mol Na và Al lần lượt là 2x và 4x (mol)
Khi cho hỗn hợp vào nước ta có thứ tự phản ứng:
2Na + 2H2O → 2NaOH + H2
2x ---------------------->2x x
Al + NaOH + H2O → NaAlO2 + 1,5H2
2x 2x 3x
=> ΣnH2 = x + 3x = 8,96:22,4 = 0,4
=> x = 0,1
=> nAl dư = 4x - 2x = 0,2 mol
<=> m CR không tan = mAl dư = 0,2.27 = 5,4 gam