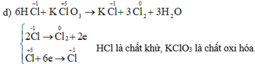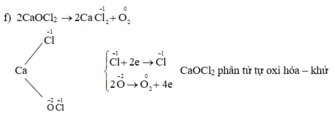Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$a\bigg)$
$Cl_2+H_2O\leftrightharpoons HCl+HClO$
$CH_4+Cl_2\xrightarrow{ánh\, sáng}CH_3Cl+HCl$
$CH_3Cl+Cl_2\xrightarrow{ánh\, sáng}CH_2Cl_2+HCl$
$CH_2Cl_2+Cl_2\xrightarrow{ánh\, sáng}CHCl_3+HCl$
$CHCl_3+Cl_2\xrightarrow{ánh\, sáng}CCl_4+HCl$
$b\bigg)$
- Chất khử:
$2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O$
- Chất oxi hóa:
$Fe+2HCl\to FeCl_2+H_2$
- Chất trao đổi:
$AgNO_3+HCl\to AgCl\downarrow+NaNO_3$

Vai trò các chất trong các phản ứng oxi hóa – khử sau là:
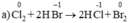
Chất khử 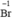 (trong HBr), chất oxi hóa Cl2
(trong HBr), chất oxi hóa Cl2
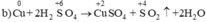
Chất khử Cu, chất oxi hóa 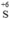 (trong H2SO4)
(trong H2SO4)
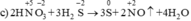
Chất khử 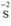 (trong H2S), chất oxi hóa
(trong H2S), chất oxi hóa 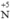 (trong HNO3)
(trong HNO3)
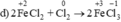
Chất khử 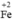 (trong FeCl2), chất oxi hóa
(trong FeCl2), chất oxi hóa 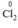

PT:
Fe + S-->FeS (to)
FeS + H2SO4-->H2S + FeSO4
Vai trò:chất oxi hóa

HCl 2 HCl + Fe → FeCl 2 + H 2 4 HCl + MnO 2 → MnCl 2 + Cl 2 + 2 H 2 O

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
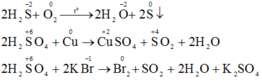

a) KClO3 + 6HCl --> KCl + 3Cl2 + 3H2O
Chất khử: HCl, chất oxh: KClO3
| QT khử | Cl+5 + 6e --> Cl-1 | x1 |
| QT oxh | 2Cl-1 - 2e --> Cl20 | x3 |
b) 2KMnO4 --to--> K2MnO4 + MnO2 + O2
Chất khử: KMnO4, chất oxh: KMnO4
| QT khử | 2Mn+7 + 4e --> Mn+6 + Mn+4 | x1 |
| QT oxh | 2O-2 - 4e --> O20 | x1 |
\(a.QToxh:2\overset{-1}{Cl}\rightarrow Cl_2+2e|\times5\\QTkhử:2\overset{+5}{Cl}+10e\rightarrow \overset{0}{Cl_2}|\times1\)
HCl là chất oxi hóa, KClO3 là chất khử
\(KClO_3+6HCl_{đặc}\rightarrow KCl+3Cl_2+3H_2O\)
\(b.QToxh:2\overset{-2}{O}\rightarrow\overset{0}{O_2}+4e|\times1\\ QTkhử:2\overset{+7}{Mn}+4e\rightarrow\overset{+6}{Mn}+\overset{+4}{Mn}|\times1\)
KMnO4 vừa là chất khử, vừa là chất oxi hóa
\(2KMnO_4-^{t^o}\rightarrow K_2MnO_4+MnO_2+O_2\)

SO 2 2 SO 2 + 2 H 2 O + O 2 → 2 H 2 SO 4 2 H 2 S + SO 2 → 2 H 2 O + 3 S