
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 6:
nAl=3,24/27=0,12(mol); nO2= 4,48/22,4=0,2(mol)
PTHH: 4 Al + 3 O2 -to-> 2 Al2O3
Ta có: 0,12/4 < 0,2/3
=> O2 dư, Al hết, tính theo nAl
=> nAl2O3(LT)= nAl/2= 0,12/2=0,06(mol)
nAl2O3(TT)=4,59/102=0,045(mol)
=> H= (0,045/0,06).100= 75%
Câu 7:
nMg=6/24=0,25(mol); nS= 8,8/32=0,275(mol)
PTHH: Mg + S -to-> MgS
Ta có: 0,25/1 < 0,275/1
=> Mg hết, S dư, tính theo nMg
=> nMgS(LT)=nMg= 0,25(mol)
nMgS(TT)= 10,08/56= 0,18(mol)
=>H= (0,18/0,25).100=72%

Một số gốc axit thường gặp:
-F: florua
-I: iotua
-Cl: clorua
- NO3: nitrat
- NO2:nitrit
= SO4: sunfat
= SO3: sunfit
=CO3: cacbonat
một số gốc axit thường gặp :
\(-\) Cl ( clorua)
\(-\) S ( sunfur)
= SO4 ( sunfat)
= SO3 ( sunfit)
\(-\) NO3( nitrat)
\(-\) NO2 ( nitrit)
\(\equiv\) PO4 ( photphat)
( một \(-\) tương ứng với 1 hóa trị )
khuyến mại tên lun đó!!

(1) K + O2 \(-^{t0}->K2O\)
(2) \(K2O+H2SO4->K2SO4+H2O\)
(4) \(K2SO4+Ba\left(OH\right)2->2KOH+B\text{aS}O4\downarrow\)
\(\left(5\right)KOH+HCl->KCl+H2O\)
\(\left(6\right)2KCl+2H2O\xrightarrow[\text{đ}i\text{ện}-ph\text{â}n]{c\text{ó}-m\text{àng}-ng\text{ă}n}2KOH+Cl2\uparrow+H2\uparrow\)
\(\left(7\right)KOH+Al\left(OH\right)3->KAlO2+2H2O\)
Cái thứ 8 chưa làm bao h :- ?

a) Phương trình:
Zn + HCl -> ZnCl2 + H2
b) Ta có :
nZn = 13/65 = 0,2 (mo)
Theo phương trình, ta có :
2nZn = nHCl = 0,2.2=0,4(mol)
Số mol Zn = số mol ZnCl2 = số mol H2 = 0,2mol
Tự tính thể tích nha cậu từ tớ ghi số mol ra hết rồi. Cậu ghi đề chung chung quá tớ không biết muốn tích thể tích nào.

Bạn dùng nam châm hút các vụn sắt ra , vậy là đã tách đc hỗn hợp vụn sắt và vụn cát rồi :D

a)5Zn:5 nguyên tử kẽm
2Ca:2 nguyên tử Canxi
b)hình như là đề bạn chưa ghi hết hở

nCO(phản ứng) = 11,2/22.4 =0.5 mol
PTHH: 2Fe2O3 + 6CO ===> 4Fe + 6CO2
1 3 2 3 (MOL)
Fe3O4 + 4CO ==> 3Fe + 4CO2
1 4 3 4
nhìn vào PTHH ta thấy nCO= nCO2 = 0.5
áp dụng định Luật BTKL ==> mFe(thu đc) = mhhA + mCO - mCO2
= 27.6 + 0.5x 28 - 0.5x44
=19.6 g
m chưa nháp lại đâu, bạn nên kiểm tra lại, còn cách làm thì mik thấy đúng nhá, lke cho mik hát bh mik làm tiếp nha ^_~
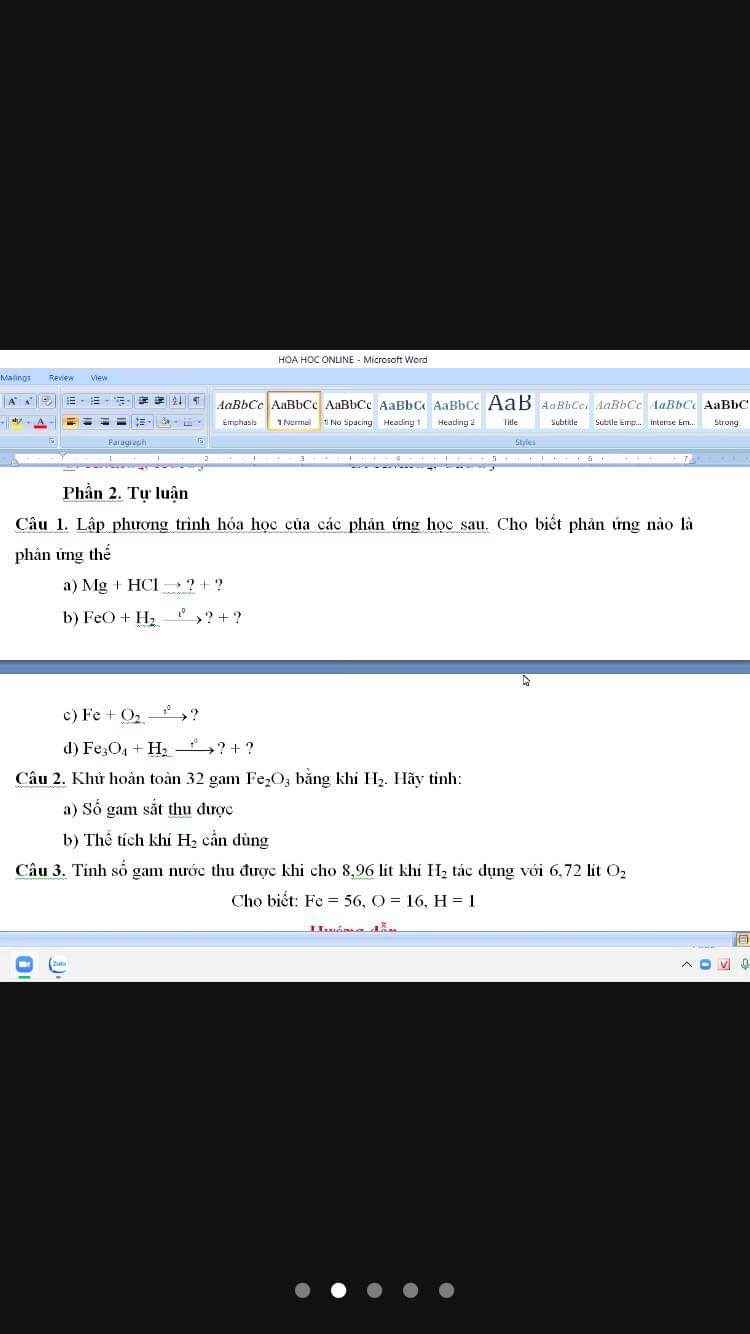



Câu 1.
c)\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
d)\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)\(\Rightarrow\) phản ứng thế