Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử KL có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}nH_2=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,8}{\dfrac{0,4}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MM = 24 (g/mol) là tm
Vậy: M là Mg.
Ta có: \(n_{MgCl_2}=n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,2.95=19\left(g\right)\)

Gọi số mol Zn, AL là a, b (mol)
=> 65a + 27b = 3,79 (1)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
a---->a------------------->a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b---->1,5b-------------------->1,5b
=> a + 1,5b = 0,08 (2)
(1)(2) => a = 0,05; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,05.65}{3,79}.100\%=85,752\%\\\%m_{Al}=\dfrac{0,02.27}{3,79}.100\%=14,248\%\end{matrix}\right.\)
\(n_{H_2SO_4}=a+1,5b=0,08\left(mol\right)\)
=> \(m_{H_2SO_4}=0,08.98=7,84\left(g\right)\)
Zn + H2SO4 -> ZnSO4 + H2
a -> a
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
b -> 1.5b
HPT: 65a+27b=3.79
a + 1.5b = 1.792/22.4= 0.08
Giải HPT ta được a=0.05 b=0.02
mZn = 0.05*65=3.25 (g)
mAl= 0.02*27=0.54 (g)

nHCl=2.0,1=0,2mol
PTHH: Fe+2HCl=>FeCl2+H2
0,1<-0,2--->0,1---->0,1
mFe phản ứng=0,1.56=5,6g
VH2 thu đc=0,1.22,4=2,24 lít

2Al+6Hcl->2AlCl3+3H2
x-----------------x--------3\2x
Fe+2HCl->FeCl2+H2
y-----------------y------y
Ta có :
\(\left\{{}\begin{matrix}27x+56y=9,65\\\dfrac{3}{2}x+y=0,325\end{matrix}\right.\)
=>x=0,15 mol, y=0,1 mol
=>m Al=0,15.27=4,05g
=>m Fe=56.0,1=5,6g
b)
=>m AlCl3=0,15.133,5=20,025g
=>m FeCl2=0,1.127=12,7g
\(\left\{{}\begin{matrix}Al\\Fe\end{matrix}\right.+HCl->\left\{{}\begin{matrix}AlCl3\\FeCl2\end{matrix}\right.+7,28lH2\)
a,
Ta có :
\(\left\{{}\begin{matrix}27x+56y=9,65\\3x+2y=0,65\left(bt-e\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}mAl=0,15.27=4,05\left(g\right)\\mFe=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b,
Bảo toàn nguyên tố :
nAl = nAlCl3 = 0,15 ( mol )
nFe = nFeCl2 = 0,1 ( mol )
Khối lượng chất tan A :
m = 0,15 . 133,5 + 0,1 . 127 = 32,725(g)

\(n_{SO2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
a 0,15 1a
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
b 0,075 1,5b
a) Gọi a là số mol của Cu
b là số mol của Fe
\(m_{Cu}+m_{Fe}=18\left(g\right)\)
⇒ \(n_{Cu}.M_{Cu}+n_{Fe}.M_{Fe}=18g\)
⇒ 64a + 56b = 18g (1)
Theo phương trình : 1a + 1,5b = 0,375(2)
Từ(1),(2), ta có hệ phương trình :
64a + 56b = 18g
1a + 1,5b = 0,375
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) 0/0Cu = \(\dfrac{9,.6.100}{18}=53,33\)0/0
0/0Fe = \(\dfrac{8,4.100}{18}=46,67\)0/0
c) Có : \(n_{Cu}=0,15\left(mol\right)\Rightarrow n_{CuSO4}=0,15\left(mol\right)\)
\(n_{Fe}=0,15\left(mol\right)\Rightarrow n_{Fe2\left(SO4\right)3}=0,075\left(mol\right)\)
\(m_{CuSO4}=0,15.160=24\left(g\right)\)
\(m_{Fe2\left(SO4\right)3}=0,075.400=30\left(g\right)\)
Chúc bạn học tốt

Đáp án C
Xử lí dữ kiện Z: Bảo toàn khối lượng:
![]() = 6,12 gam
= 6,12 gam
→![]() gam →
gam →
![]() mol
mol
→ ![]() gam →
gam →
![]() mol.
mol.
![]()
![]() gam
gam
![]() mol
mol
![]()
![]()
Ta có phản ứng Dumas: -COONa + NaOH → -H + Na2CO3 (vôi tôi xút).
![]()
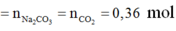
![]()
![]()
K gồm 2 khí trong đó có CH4.
Mà sau khi dẫn qua dung dịch Br2 dư chỉ còn 1 khí thoát ra
⇒ khí còn lại bị hấp thụ.
![]()
trong A chứa 2 gốc CH3COO-
⇒ gốc còn lại cũng là gốc axit đơn chức
⇒ nkhí còn lại = nA = 0,12 mol.
⇒ Mkhí còn lại =
![]()
khí còn lại là C2H4.
⇒ là (CH3COO)2(CH2=CH-COO)C3H5
⇒ a = 0,12 . 230 = 2,76
![]() mol
mol
⇒ x = 0,38 ÷ 0,19 = 2.
Muối gồm 0,12 mol
![]() ;
;
0,24 mol CH3COONa; 0,02 mol NaCl
=> b = 0,12.94 + 0,24.82 + 0,02.58,5 = 32,13
=> a + b + x = 61,73 gam


1.
nCuO = 0,4 mol
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(\Rightarrow\) VH2 = 0,4.22,4 = 8,96 (l)
\(\Rightarrow\) mCu = 0,4.64 = 25,6 (g)
2.
nH2 = 0,5 mol
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
\(\Rightarrow\) mHCl = 1.36,5 = 36,5 (g)
\(\Rightarrow\) mZnCl2 = 0,5.136 = 68 (g)