Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

nCO2=0.09(mol)
PTHH:Na2CO3+H2SO4->Na2SO4+CO2+H2O
2NaHCO3+H2SO4->Na2SO4+2CO2+2H2O
Gọi nNa2CO3 là x(mol)->nCO2(1)là x(mol)
nNaHCO3 là y(mol)->nCO2(2) là y(mol)
theo bài ra ta có:x+y=0.09
106x+84y=9.1
x=0.07(mol).mNa2Co3=7.42(g) %Na2CO3=81.5%
y=0.02(mol) mNaHCO3=1.68(g)%NaHCO3=18.5%
nH2SO4(1)=nNa2CO3=0.07(mol)
nH2SO4(2)=1/2 nNaHCO3->nH2SO4(2)=0.01(mol)
tổng nH2SO4=0.08(mol)
mH2SO4=7.68(g)
mDd axit=15.36(g)

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
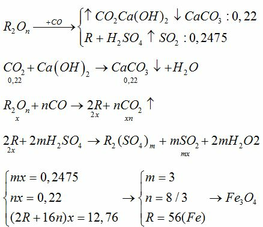
Cặp chất nào sau đây có thể cùng tồn tại trong một dung dịch :
A.KCl và AgNO 3
B.BaCl 2 và Na 2 SO 4 ;
C.BaCl 2 và H 2 SO 4
D.KCl và NaNO 3
Sục khí CO 2 dư vào dung dịch NaOH, sản phẩm tạo ra là:
A.Na 2 CO 3 + H 2 O
B.Na 2 CO 3 + NaHCO 3 + H 2 O
C.NaHCO 3 + H 2 O
D.Na 2 CO 3 + NaHCO 3
Dung dịch NaOH có thể tác dụng được với dd :
A.Cu(NO 3 ) 2
B.CaCl 2
C.Ba(NO 3 ) 2
D.K 2 CO 3
Hấp thụ hoàn toàn 3,36 lít khí SO 2 (ở đktc) trong 400 ml dung dịch NaOH, tạo ra 16,7 gan muối. Tính C M của dung dịch NaOH đã dùng.
A.0,75M
B.0,375M
C.0,05M
D.0,5M
\(Đặt:\left\{{}\begin{matrix}n_{NaHSO_3}=x\left(mol\right)\\n_{Na_2SO_3}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x+y=0,15\\104x+126y=16,7\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
Hòa tan hoàn toàn 9,6 gam 1 kim loại R trong dung dịch H 2 SO 4 đặc nóng thu được 3,36 lít khí
SO 2 (ở đktc). Tìm kim loại R.
A.Fe
B.Mg
C.Cu
D.Al