Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{H_2O}=\dfrac{33,3-20,34}{18}=0,72\left(mol\right)\)
\(n_{KCl.MgCl_2.xH_2O}=\dfrac{33,3}{169,5+18x}\left(mol\right)\)
=> \(\dfrac{33,3}{169,5+18x}.x=0,72\)
=> x = 6
b)
\(n_{KCl.MgCl_2.6H_2O}=\dfrac{33,3}{277,5}=0,12\left(mol\right)\)
1 mol KCl.MgCl2.6H2O có 3 mol Cl
=> nCl = 0,36 (mol)
Số nguyên tử Cl = 0,36.6.1023 = 2,16.1023 (nguyên tử)

Bài này phải cho giá trị của x mới làm được.
Cacnalit là muối KCl.MgCl2.6H2O
➝ Phân tử khối của cacnalit là: (39 + 35,5) + (24 + 35,5.2) + 6.(2 + 16) = 277,5 g/mol
➝ n cacnalit = 33,3/277,5 = 0,12 mol
Cứ 1 phân tử KCl.MgCl2.6H2O có 3 nguyên tử clo
➝ 0,12 mol KCl.MgCl2.6H2O có 0,12.3 = 0,36 mol clo
➝ số nguyên tử clo có trong 33,3 gam cacnalit là 0,36.6,02.1023 = 2,1672.1023
Cho 26g kẽm phản ứng hoàn toàn với dung dịch axit Clohiđric (dư) thử được kẽm clorua (ZnCl2) và khí hiđro.
a, Viết phản ứng hóa học cho phản ứng
b, Tính thể tích khí hiđro sinh ra ở (điều kiện tiêu chuẩn)
c, Tính khối lượng mối thu được sau phản ứng

\(n_{MCl_2}=n_{MCl_2\cdot2H_2O}=\dfrac{8.32}{137+35.5\cdot2}=0.04\left(mol\right)\)
\(m_{MCl_2\cdot2H_2O}=0.04\cdot\left(137+71+2\cdot18\right)=7.6\left(g\right)\)

Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
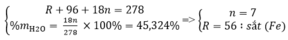
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O

mdd = 86,26 – 60,26 = 26(g)
mct = 66,26 – 60,26 = 6 (g) ⇒ mH2O = 26 - 6 = 20g
Độ tan của muối ở 20°C là:
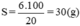
Vậy độ tan của muối ở 20°C là 30 gam
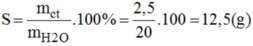
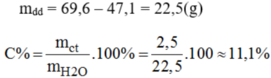
\(KCl.MgCl_2.xH_2O\rightarrow KCl+MgCl_2+xH_2O\)
a a a
Ta có: \(m_{muối}=m_{KCl}+m_{MgCl_2}\Leftrightarrow6,78=74,5a+95a\Leftrightarrow a=0,04\)
\(\Rightarrow M_{KCl.MgCl_2.xH_2O}=\dfrac{11,1}{0,04}=277,5\Leftrightarrow74,5+95+18x=277,5\Leftrightarrow x=6\)
Vậy có 6 phân tử nước