Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

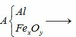
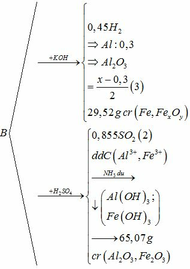
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
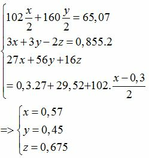
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
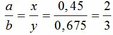
=> Fe2O3

Cu Ag Fe Al → O 2 , t 0 Y → HCldu A → NaOH kt → t 0 Z
– Tác dụng với oxi dư
2Cu + O2 →2CuO
4Fe + 3O2→2Fe2O3
4Al + 3O2 →2Al2O3
– Tác dụng với HCl dư
CuO +2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
– Tác dụng với NaOH dư
NaOH + HCl → NaCl + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
AlCl3 + 3NaOH → 2H2O + 3NaCl + NaAlO2
– Nung trong không khí
2Fe(OH)3 →Fe2O3 + 3H2O
Cu(OH)2→CuO + H2O
=> Z gồm CuO và Fe2O3

a)
Mg + 2HCl --> MgCl2 + H2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
MgCl2 + 2KOH + 2KCl + Mg(OH)2
FeCl3 + 3KOH --> 3KCl + Fe(OH)3
Mg(OH)2 --to--> MgO + H2O
2Fe(OH)3 --to--> Fe2O3 + 3H2O
b) Gọi số mol Mg, Fe2O3 là a, b (mol)
Theo PTHH: \(a=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PTHH: \(n_{MgO}=n_{Mg}=a=0,15\left(mol\right)\)
=> \(n_{Fe_2O_3\left(chất.rắn.sau.khi.nung\right)}=\dfrac{22-0,15.40}{160}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe_2O_3\left(bđ\right)}=n_{Fe_2O_3\left(chất.rắn.sau.khi.nung\right)}=0,1\left(mol\right)\)
=> b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{0,15.24+0,1.160}.100\%=18,37\%\\\%m_{Fe_2O_3}=\dfrac{0,1.160}{0,15.24+0,1.160}.100\%=81,63\%\end{matrix}\right.\)

Gọi số mol của NaHCO3 và Na2CO3 trong 2 phần lần lượt là x và y (mol)
Phần I :
2NaHCO3 + Ba(OH)2 --> BaCO3↓ + Na2CO3 + H2O
Na2CO3 + Ba(OH)2 --> BaCO3↓ + NaOH
=> nBaCO3 = 1/2nNaHCO3 + nNa2CO3 = (x/2 + y) mol
=> m1 = (x/2 + y).197 gam
Phần II :
Na2CO3 + BaCl2 --> BaCO3↓ + 2NaCl
=> nBaCO3 = y mol <=> m2 = 197y gam
mà \(\dfrac{m_1}{m_2}=1.25\) => \(\dfrac{\text{(x/2 + y).197}}{197y}\)=1,25
Rút gọn phương trình => y = 2x
Vậy hỗn hợp A gồm NaHCO3 và Na2CO3 với nNa2CO3 = 2nNaHCO3
=> mA = 84x + 106.2x = 296x gam
%mNaHCO3 = \(\dfrac{84x}{296x}.100\)= 28,37% và %mNa2CO3 = 100-28,37 =71,63%

Gọi số mol của BaO, BaCO3, NaHCO3 trong 30,19g hh lần lượt là x, y, z
Có 153x + 197y + 84z = 30,19
Phần 1:
BaO + H2O → Ba(OH)2
x x
OH- + HCO3- → CO32- + H2O
Ba2+ + CO32- → BaCO3
n kết tủa = 0,11
Phần 2:
BaCO3 →BaO + CO2
y y
2NaHCO3 → Na2CO3 + H2O + CO2
z z/2 z/2
=> mCO2 + mH2O = 30,19 – 26,13 = 4,06
=> 44 (y + z/2) + 18 . z/2= 4,06
TH1: Ba tạo kết tủa hoàn toàn thành BaCO3 và NaHCO3 dư
=> nBaCO3 = nBaCO3 + nBaO = 0,11 => Không thỏa mãn
TH2: Ba(OH)2 dư và NaHCO3 hết
=> x + y = 0,11 và y + z = 0,11
=> x = 0,1; y = 0,05 và z = 0,06
a.
hh Y gồm BaO: 0,15 mol; Na2CO3: 0,03 mol
BaO + H2O → Ba(OH)2
0,15 0,15
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
0,15 0,03 0,03 0,06
=> m kết tủa = 0,03 . 197 = 5,91g
m dd = m chất rắn + mH2O – mBaCO3 = 26,13 + 79,78 – 5,91 = 100
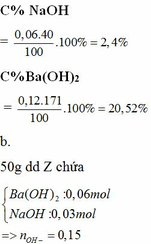
nAl2(SO4)3 = 0,02 => nAl3+ = 0,04; nSO42- = 0,06
Ba2+ + SO42- → BaSO4
0,06 0,06 0,06
nAl(OH)3 = 0,01 => mAl(OH)3 = 0,78g
m = 0,78 + 0,06 . 233 = 14,76g

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g


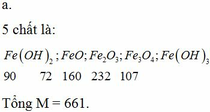
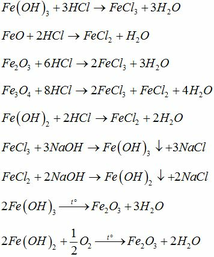
Gọi a,b,c,d là số mol mỗi ion ở từng phần.
ta lập đc hệ:
51a+80b=2,11
90b+233c=6,46
3a+2b=2c+d
từ đó ta suy ra đc:
m/2=133,5a+127b+25c
Thế các gia trị của m trong đáp án ta chọn được D
vì K+ và Na+ nên viết p.tử không chuẩn
a) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước vì nộng độ H+trong dd mới tạo thành nhỏ nên sẽ tác dụng từng nấc(vì chỉ từng giọt).lượng H+ chưa dư khi tác dụng với CO32- nên không thể tác dụng tiếp với HCO3- dẫn đến không có hiện tượng
H++CO32- -->HCO3-
b) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước. H+ tác dụng với CO32- còn dư tác dụng với 1 phần HCO3- tạo CO2 khí ko màu dd còn HCO3- tác dụng với OH- tạo CO32- td Ba2+ tạo kt trắng BaCO3
CO32-+H+-->HCO3-
HCO3-+H+-->H2O+CO2
HCO3-+OH-+Ba2+-->BaCO3+H2O(dư nên khi vậy ko dư ghi tỉ lệ Ba2+:OH-=1:2)
c)cho từ từ CO32- và HCO3- vào H+ thì pứ xảy ra đồng thời tạo đều tạo khí CO2 vì khi cho vào thì mt có nồng độ H+ lớn nên pứ xảy ra theo 2 nấc đồng thời
CO32-+2H+-->H2O+CO2
HCO3-+H+-->H2O+CO2