Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam

Chào em, với dạng bài này là cơ bản lắm nên em phải tự giải được. Anh giúp em 1 lần thôi nha!
\(PTK_{hc}=36.PTK_{H_2}=36.2=72\left(đ.v.C\right)\\ Đặt:Fe_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{77,78\%.72}{56}=1\\ y=\dfrac{72-56.1}{16}=1\\ Với:x=1;y=1\rightarrow CTHH:FeO\)
Còn ý nghĩa em nắm 3 điều sau nha!
- Thứ nhất là hợp chất tạo bởi bao nhiêu nguyên tố, đó là những nguyên tố nào?
-Thứ hai, mỗi nguyên tố có bao nhiêu nguyên tử?
- Thứ ba, phân tử khối của hợp chất là bao nhiêu?
---
Đối với hợp chất FeO, thì công thức hợp chất này có ý nghĩa:
- Hợp chất cấu tạo bởi 2 nguyên tố hóa học là Fe và O.
- Hợp chất bao gồm 1 nguyên tử nguyên tố sắt và 1 nguyên tử nguyên tố Oxi.
- PTKFeO= NTKFe + NTKO= 56+16=72(đ.v.C)
* Hóa trị của Fe trong hợp chất là : II
Có gì không hiểu, em có thể hỏi lại nha ^^
Làm xong các dạng này, em có thể tự mở rộng ra bằng các loại sách nâng cao khác nghen em
Gọi CTHH của hợp chất là $Fe_xO_y$
Ta có :
$\%Fe = \dfrac{56x}{56x + 16y}.100\% = 77,78\%$
$\Rightarrow x = y$
Mặt khác : $M_{hợp\ chất} = 56x + 16y = 36M_{H_2} = 72$
Suy ra: $x = y = 1$
Vậy CTHH cần tìm là $FeO$
Gọi hóa trị của Fe là a
Theo quy tắc hóa trị, ta có: a.I = II.1 Suy ra a = II
Vậy Fe có hóa trị II trong hợp chất
Ý nghĩa :
- Phân tử được cấu tạo bởi 2 nguyên tố : Sắt và Oxi
- Tỉ lệ số nguyên tử Fe : số nguyên tử O là 1 : 1
- PTK = 72 đvC

Gọi công thức chung là FexSyOz
%O2=48%
x:y:z=\(\dfrac{28}{56}:\dfrac{24}{32}:\dfrac{48}{16}=0,5:0,75:3=2:3:12\)
=> CTHH Fe2(SO4)3
tên: Sắt (III)sunfat

1A
2D
3D
4B ( CO là oxit trung tính)
5C ( NO là oxit trung tính)
6A ( N2O là oxit trung tính )
7D ( %O trog CuO là 20 , %O trog MgO là 60;% O trog ZnO là 19,754 , % O trog PbO là 7,175)
8D
9C
10A
11B
12D
13B
14D
15B
16C
17B
18C
19C
20C
21B ( oxit trug tính)
22C
23B
24D
25A
26B
( chx hỉu hỏi lại )
1.A
2.C hoặc D ko rõ
3.D
4.C
5.C
6.A
7.D
8.D
9.C
10.A
11.B
12.B
13.B
14.D
15.D
16.C
17.B
18. C
19.C
20.C
21.C
22.C
23.B
24.D
25.A
26.B

Giả sử khối lượng oxit là 10g ⇒ m F e = 7g ; m O = 3g
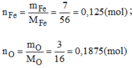
Vậy: 0,125 mol nguyên tử Fe kết hợp với 0,1875 mol nguyên tử O.
Suy ra 2 mol nguyên tử Fe kết hợp với 3 mol nguyên tử O (vì số nguyên tử luôn là số nguyên).
→ Công thức hóa học đơn giản của oxit sắt là: F e 2 O 3

CTHH: CuxOy
Có: \(\dfrac{m_{Cu}}{m_O}=\dfrac{8}{1}\Rightarrow\dfrac{64x}{16y}=\dfrac{8}{1}\)
=> \(\dfrac{x}{y}=\dfrac{2}{1}\)
=> CTHH: Cu2O

a) Với Fe3O4 thì Fe là 72,4% và O là 27,6%;
Với Fe2O3 thì Fe là 70% và O là 30%
b) Với SO2 thì S là 50% và O là 50%
Với SO3 thì S là 40% và O là 60%
c) mCu= \(\dfrac{80.80}{100}\)=64(g) ; mO=\(\dfrac{80.20}{100}\)=16(g)
nCu=\(\dfrac{64}{64}\)=1(mol) ; nO=\(\dfrac{16}{16}\)=1(mol)
Vậy CTHH của oxit đồng màu đen là: CuO
d) dA/H2=\(\dfrac{Ma}{2}\)=17 => MA=2.17=34(đvC)
H =\(\dfrac{5,88.34}{100}\)\(\approx\)2(đvC) ; S =\(\dfrac{94,12.34}{100}\)\(\approx\)32
=> CTHH của chất khí A là SH2

\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=\dfrac{64.50}{100}=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
Gọi cthc: CuSOx
MCuSOx = 160
\(\Leftrightarrow16x=64\)
=> x = 4
Vậy cthc: CuSO4
b) Gọi cthc: FexOy , x, y \(\in Z^+\)
\(\dfrac{m_{Fe}}{m_O}=\dfrac{7}{3}\)
\(\Leftrightarrow\dfrac{56x}{16y}=\dfrac{7}{3}\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy cthc: Fe2O3