Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Ca có 2 electron ở lớp ngoài cùng (giống như nguyên tử Mg) => Dễ dàng cho đi 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- O có 6 electron ở lớp ngoài cùng => Dễ dàng nhận thêm 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
Cái sơ đồ em vẽ vòng e của 2 nguyên tử dùng dấu + xong -> thành 2 vòng e các nguyên tử sát nhau

Khi biết được hóa trị của các nguyên tố trong hợp chất ta có thể xác định được công thức hóa học của hợp chất.

| Nguyên tố | Si | O |
| Hóa trị | IV | II |
| Số nguyên tử | 1 | 2 |
| Tích hóa trị và số nguyên tử | IV x 1 II.2 |
=> Tích hóa trị và số nguyên tử của nguyên tố Si = tích hóa trị và số nguyên tử của nguyên tố O

`#3107.101107`
PTK của phân tử khí N2 là:
\(14\cdot2=28\left(\text{amu}\right)\)
Tương tự các chất còn lại:
`@` H2O
\(1\cdot2+16=2+16=18\left(\text{amu}\right)\)
`@` CaO
`40 + 16 = 56 (\text{amu})`
`@` Fe: `56` amu
______
- Khi hình thành hợp chất NaCl, các nguyên tử đã có sự nhường nhận e như sau:
+ Ng tử Na nhường 1 e ở lớp ngoài cùng cho nguyên tử Cl để tạo thành ion dương Na+ và có vỏ bền vững giống khí hiếm Neon.
+ Ng tử Cl nhận 1 e vào lớp ngoài cùng từ nguyên tử Na để tạo thành ion âm Cl- và có vỏ bền vững giống khí hiếm Argon.
Hai ion mang điện tích ngược dấu, hút nhau hình thành liên kết ion trong hợp chất NaCl.
Vậy, hc NaCl thuộc loại liên kết ion.

Phân tử đơn chất : O
phân tử liên kết ion: O2
phân tử liên kết cộng hóa trị: H2O
như vầy đc chưa

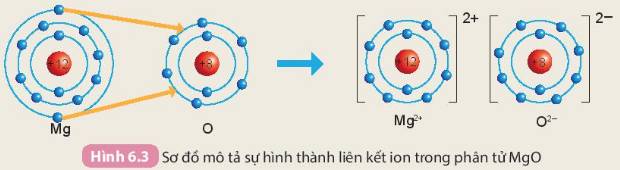
Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.

Liên kết ion:
`-` Liên kết ion được hình thành bởi lực hút giữa `2` ion trái dấu `(` Kim loại `-` Phi kim`)`.
Liên kết cộng hóa trị:
`-` Liên kết cộng hóa trị được hình thành giữa `2` nguyên tử bằng một hay nhiều cặp electron dùng chung.


Calcium oxide: Khi kim loại calcium kết hợp với phi kim oxygen, tạo thành các ion Ca2+ và O2-. Các ion này tích điện trái dấu sẽ hút nhau tạo thành liên kết ion.