Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe\left(a\right)+2HCl\rightarrow FeCl_2\left(a\right)+H_2\)
\(Mg\left(1-a\right)+2HCl\rightarrow MgCl_2\left(1-a\right)+H_2\)
Đặt tổng số mol hỗn hợp là 1 mol.
Gọi a là số mol của Fe trong hỗn hợp trên (a < 1 )
=> \(n_{Mg}=\left(1-a\right)\left(mol\right)\)
\(\Rightarrow m_X=56a+\left(1-a\right)24=32a+24\left(g\right)\)
Theo PTHH \(n_{HCl}=2n_{hh}=2\left(mol\right)\)
\(\Rightarrow m_{HCl}=73\left(g\right)\)
\(\Rightarrow m_{ddHCl}=365\left(g\right)\)
Theo PTHH: \(n_{H_2}=n_{hh}=1\left(mol\right)\)
\(\Rightarrow m_{H_2}=2\left(g\right)\)
\(m dd sau = 32a+24+365-2=32a+387(g)\)
Theo đề, ta có: \(15,757=\dfrac{127a.100}{32a+387}\)
\(\Rightarrow a=0,5\)
Theo PTHH: \(n_{MgCl_2}=1-a\left(mol\right)\)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{95\left(1-a\right).100}{32a+387}=\dfrac{95\left(1-0,5\right).100}{32.0,5+387}=11,7866\%\)

Fe +2HCl --> FeCl2 +H2 (1)
Mg +2HCl --> MgCl2+H2(2)
giả sử có 1 mol hh
theo (1,2) : nHCl=2nhh=2(mol)
=>mddHCl=\(\dfrac{2.36,5.100}{20}=365\left(g\right)\)
nH2=nhh=1(mol)
=>mH2=2(g)
giả sử trong 1 mol hh có x mol Fe , y mol Mg
=> x+y=1(I)
mddsau pư=56x+24y+365-2=56x+24y+363(g)
=>\(\dfrac{127x}{56x+24y+363}.100=15,757\)(II)
từ (I) và (II) :
=>\(\left\{{}\begin{matrix}x=0,5\left(mol\right)\\y=0,5\left(mol\right)\end{matrix}\right.\)
theo (2) : nMgCl2=nMg=0,5(mol)
=> mMgCl2=47,5(g)
mdd sau pư=56.0,5+24.0,5+363=403(g)
=> C%ddMgCl2=\(\dfrac{47,5}{403}.100\approx11,79\left(\%\right)\)
b) %mFe=\(\dfrac{0,5.56}{0,5.\left(56+24\right)}.100=70\left(\%\right)\)

\(Fe+2HCl->FeCl_2=H_2\\ Mg+2HCl->MgCl_2+H_2\\ n_{Fe}=a;n_{Mg}=b\\ m_{ddHCl}=\dfrac{36,5.2\left(a+b\right)}{0,25}=292\left(a+b\right)\left(g\right)\\ m_{ddD}=292\left(a+b\right)+24a+56b-2\left(a+b\right)=314a+346b\left(g\right)\\ \%m_{FeCl_2}=\dfrac{127a}{314a+346b}=\dfrac{16,61}{100}\\ a=0,768b\\ \%m_{MgCl_2}=\dfrac{95b}{314a+346b}.100\%=\dfrac{95b}{314.0,768b+346b}.100\%=16,18\%\)

a, Ta có: 27nAl + 56nFe = 22 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{19,832}{24,79}=0,8\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,4\left(mol\right)\\n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{22}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,5}=3,2\left(M\right)\)

a) Gọi $n_{Al} =a (mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b = 13(1)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra : $a = \dfrac{1}{15} ; b = 0,2$
$\%m_{Al} = \dfrac{ \dfrac{1}{15}.27}{13}.100\% = 13,8\%$
$\%m_{Fe} = 100\% - 13,8\% = 86,2\%$
b) $n_{HCl} = 2n_{H_2} = 0,3.2 = 0,6(mol)$
$\Rightarrow C_{M_{HCl}} = \dfrac{0,6}{0,15} = 4M$
c) $n_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13 + 0,6.36,5 - 0,3.2 = 34,3(gam)$

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

Giả sử số mol H2SO4=1 mol ➞khối lượng dung dịch HCl=98:0,2=490 (g)
X phản ứng vừa đủ với 1 mol H2SO4 sinh ra 1 mol H2
Đặt số mol Zn=x và số mol Mg=y mol ➞\(\Sigma\)khối lượng kim loại=65x+24y
Theo định luật bảo toàn electron➞ 2x+2y=\(2n_{H_2}=2\)
Khối lượng dung dịch sau phản ứng=\(490+65x+24y-1.2=488+65x+24y\)
Nồng độ % MgSO4=\(\frac{y\left(24+96\right)}{488+65x+24y}\)=0,1522%
Giải hệ ta được x=0,333 và y=0,667
➞ Nồng độ % ZnSO4=\(\frac{0,333.\left(65+96\right)}{488+65.0,333+24.0,667}.100\%=10,2\%\)
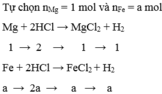
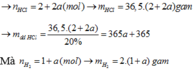
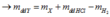
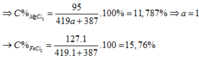
a,Giả sử mddHCl = 36,5 (g) \(\Rightarrow n_{HCl}=\dfrac{36,5.0,2}{36,5}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: a 2a a a
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: b 2b b b
Ta có: \(2a+2b=0,2\Leftrightarrow a+b=0,1\left(mol\right)\)
mdd D = 56a+24b+36,5-(a+b).2 = 56a+24b+36,3 (g)
\(C\%_{ddFeCl_2}=\dfrac{127a.100\%}{56a+24b+36,3}=15,757\%\)
\(\Leftrightarrow127a=8,82392a+3,78168b+5,719791\)
\(\Leftrightarrow118,17608a-3,78168b=5,719791\)
Ta có: \(\left\{{}\begin{matrix}a+b=0,1\\118,17608a-3,78168b=5,719791\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,05\end{matrix}\right.\)
\(C\%_{ddMgCl_2}=\dfrac{95.0,05.100\%}{56.0,05+24.0,05+36,3}=11,79\%\)