Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
Theo (1):
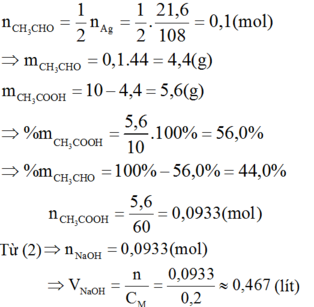

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(C_2H_5OH+Na\rightarrow C_2H_5ONa+\dfrac{1}{2}H_2\)
\(0.2..................................................0.1\)
\(n_{Ag}=\dfrac{21.6}{108}=0.2\left(mol\right)\)
\(CH_3CHO+2AgNO_3+3NH_3+H_2O\rightarrow CH_3COONH_4+2Ag+2NH_4NO_3\)
\(0.1........................................................................................0.2\)
\(n_X=0.2+0.1=0.3\left(mol\right)\)
\(\%n_{C_2H_5OH}=\dfrac{0.2}{0.3}\cdot100\%=66.67\%\)
\(\%n_{CH_3CHO}=33.33\%\)

Ta có:
\(n_{H2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
\(CH_3COOH+Na\rightarrow CH_3COONa+H_2\)
0,1_______________________________0,1
\(CH_3CH_2CHO+Na\underrightarrow{^X}\)
\(m_{CH3COOH}=0,1.64=6,4\left(g\right)\)
\(m_{CH3CH2CHO}=18,6-6,4=12,2\left(g\right)\)
\(CH_3CH_2CHO+H_2O+Br_2\rightarrow C_2H_5COOH+2HBr\)
0,2___________________0,2____________________0,9
\(\Rightarrow m_{Br2}=0,2.80.2=32\left(g\right)\)

Đáp án A
nCO2 = nH2O => Các chất trong X đều no
Y có dạng RO (a mol)
X và T có dạng R’O2 (b mol)
=> a + b = 0,2 mol (1)
Bảo toàn nguyên tố O trong X
nO(X) = 3.0,525 – 2.0,625 = 0,325 mol
=> a + 2b = 0,325 mol (2)
Từ (1,2) => a = 0,075 ; b = 0,125 mol
nAg max = 4nY = 0,3 mol
=> m = 32,4g

Đáp án A
nCO2 = nH2O => Các chất trong X đều no
Y có dạng RO (a mol)
X và T có dạng R’O2 (b mol)
=> a + b = 0,2 mol (1)
Bảo toàn nguyên tố O trong X
nO(X) = 3.0,525 – 2.0,625 = 0,325 mol
=> a + 2b = 0,325 mol (2)
Từ (1,2) => a = 0,075 ; b = 0,125 mol
nAg max = 4nY = 0,3 mol
=> m = 32,4g

Phần 1:
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH3COOH}=n_{NaOH}=0,1\left(mol\right)\)
Phần 2:
\(HCHO+4AgNO_3+6NH_3+2H_2O\rightarrow4Ag+\left(NH_4\right)_2CO_3+4NH_4NO_3\)
Ta có:
\(n_{Ag}=\frac{32,4}{108}=0,3\left(mol\right)\)
\(\Rightarrow n_{HCHO}=\frac{1}{4}n_{Ag}=0,075\left(mol\right)\)
\(\Rightarrow m=0,2.60+0,15.30=16,5\left(g\right)\)
\(m_{CH3COOH}=0,2.60=12\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH3COOH}=\frac{12}{16,5}.100\%=72,7\%\\\%m_{HCHO}=100\%-72,7\%=27,3\%\end{matrix}\right.\)