Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 6:
\(a.n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\\ n_{Mg}=\dfrac{14,4}{24}=0,6\left(mol\right)\\ PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ Vì:\dfrac{0,2}{1}< \dfrac{0,6}{2}\\ \rightarrow Mgdư\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b.m_{MgCl_2}=0,2.95=19\left(g\right)\)
c. Số phân tử chất còn dư sau phản ứng là 0. Vì chất dư sau phản ứng là nguyên tử Mg.
Bài 7:
\(a.n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{43,8}{36,5}=1,2\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Vì:\dfrac{0,3}{2}< \dfrac{1,2}{6}\\ \rightarrow HCldư\\ n_{H_2}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,45.22,4=10,08\left(l\right)\\ b.n_{AlCl_3}=n_{Al}=0,3\left(mol\right)\\ \rightarrow m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)
c. Số phân tử chất còn dư sau phản ứng là số phân tử HCl còn dư và bằng:
\(\left(1,2-\dfrac{6}{2}.0,3\right).6.10^{23}=1,8.10^{23}\left(phân.tử\right)\)

Bài 7 :
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{43,8}{36,5}=1,2\left(mol\right)\)
Pt : 2Al + 6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 3
0,3 1,2 0,3 0,45
a) Lập tỉ số so sánh : \(\dfrac{0,3}{2}< \dfrac{1,2}{6}\)
⇒ Al phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Al
Số mol của khí hidro
nH2 = \(\dfrac{0,3.3}{2}=0,45\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,45 . 22,4
= 10,08 (g)
b) Số mol của nhôm clorua
nAlCl3 = \(\dfrac{0,45.2}{3}=0,3\left(mol\right)\)
Khối lượng của nhôm clorua
mAlCl3 = nAlCl3 . MAlCl3
= 0,3. 133,5
= 40,05 (g)
c) Số mol dư của axit clohidric
ndư = nban đầu - nmol
= 1,2 - (\(\dfrac{0,3.6}{2}\))
= 0,3 (mol)
⇒ A = 0,3 . 6. 10-23 = 1,8 .10-23 (phân tử)
Chúc bạn học tốt
Bài 8 :
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Số mol của khí oxi ở dktc
nO2 = \(\dfrac{V_{O2}}{22,4}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Pt : 4Al + 3O2 → (to) 2Al2O3\(|\)
4 3 2
0,2 0,6 0,1
a) Lập tỉ số so sánh : \(\dfrac{0,2}{4}< \dfrac{0,6}{3}\)
⇒ Al phản ứng hết , O2 dư
⇒ Tính toán dựa vào số mol của Al
Số mol của nhôm oxit
nAl2O3 = \(\dfrac{0,2.2}{4}=0,1\left(mol\right)\)
Khối lượng của nhôm oxit
mAl2O3 = nAl2O3 . MAl2O3
= 0,1 . 102
= 10,2 (g)
b) Số mol dư của khí oxi
ndư = nban đầu - nmol
= 0,6 - (\(\dfrac{0,2.3}{4}\))
= 0,45 (mol)
⇒ A = 0,45 . 6 . 10-23 = 2,7 . 10-23 (phân tử)
Chúc bạn học tốt

a, \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(m_{HCl}=36,5.15\%=5,475\left(g\right)\Rightarrow n_{HCl}=\dfrac{5,475}{36,5}=0,15\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,15}{2}\), ta được Mg dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow V_{H_2}=0,075.22,4=1,68\left(l\right)\)
b, \(n_{Mg\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow n_{Mg\left(dư\right)}=0,1-0,075=0,025\left(mol\right)\)
\(\Rightarrow m_{Mg\left(dư\right)}=0,025.24=0,6\left(g\right)\)
c, - Cách 1:
\(n_{MgCl_2}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\Rightarrow m_{MgCl_2}=0,075.95=7,125\left(g\right)\)
- Cách 2:
Theo ĐLBT KL, có: mMg (pư) + mHCl = mMgCl2 + mH2
⇒ mMgCl2 = 2,4 - 0,6 + 5,475 - 0,075.2 = 7,125 (g)

1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ LTL:\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCldư\\ n_{HCl\left(pứ\right)}=2n_{Zn}=0,4\left(mol\right)\\\Rightarrow m_{HCl\left(dư\right)}=\left(0,5-0,4\right).36,5=3,65\left(g\right)\\ b.n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4,=4,48\left(l\right)\\ d.3H_2+Fe_2O_3-^{t^o}\rightarrow2Fe+3H_2O \\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\ LTL:\dfrac{0,2}{3}< \dfrac{0,12}{1}\Rightarrow Fe_2O_3dưsauphảnứng\\ \Rightarrow n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{Fe}=\dfrac{2}{15}.56=7,467\left(g\right)\)
a) n\(Zn\)=\(\dfrac{m}{M}\)=\(\dfrac{13}{65}\)=0,2(mol)
n\(HCl\)=\(\dfrac{m}{M}\)=\(\dfrac{18,25}{36,5}=\)0,5(mol)
PTHH : Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 0,5
Lập tỉ lệ mol : \(^{\dfrac{0,2}{1}}\)<\(\dfrac{0,5}{2}\)
n\(Zn\) hết , n\(HCl\) dư
-->Tính theo số mol hết
Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 -> 0,4 0,2 0,2
n\(HCl\) dư= n\(HCl\)(đề) - n\(HCl\)(pt)= 0,5 - 0,4 = 0,1(mol)
m\(HCl\) dư= 0,1.36,5 = 3,65(g)
b) m\(ZnCl2\) = n.M= 0,2.136= 27,2 (g)
c)V\(H2\)=n.22,4=0,2.22,4=4,48(l)
d) n\(Fe\)\(2\)O\(3\)=\(\dfrac{m}{M}\)=\(\dfrac{19,2}{160}\)=0,12 (mol)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2 0,12
Lập tỉ lệ mol: \(\dfrac{0,2}{3}\)<\(\dfrac{0,12}{1}\)
nH2 hết .Tính theo số mol hết
\(HCl\)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2-> 0,2
m\(Fe\)=n.M= 0,2.56= 11,2(g)

Theo gt ta có: $n_{Mg}=0,15(mol);n_{HCl}=0,4(mol)$
$Mg+2HCl\rightarrow MgCl_2+H_2$
Do đó sau phản ứng thì HCl dư 0,1(mol)

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Trc p/u: 0,1 0,1
p/u : 0,05 0,1 0,05 0,05
Sau p/u : 0,05 0 0,05 0,05
-> Fe dư sau p/u
a) \(m_{H_2}=0,05.2=0,1\left(g\right)\)
b) sau p/ư Fe dư
\(m_{Fedư}=0,05.2,8\left(g\right)\)
c) \(m_{FeCl_2}=0,05.\left(56+35,5.2\right)=6,35\left(g\right)\)

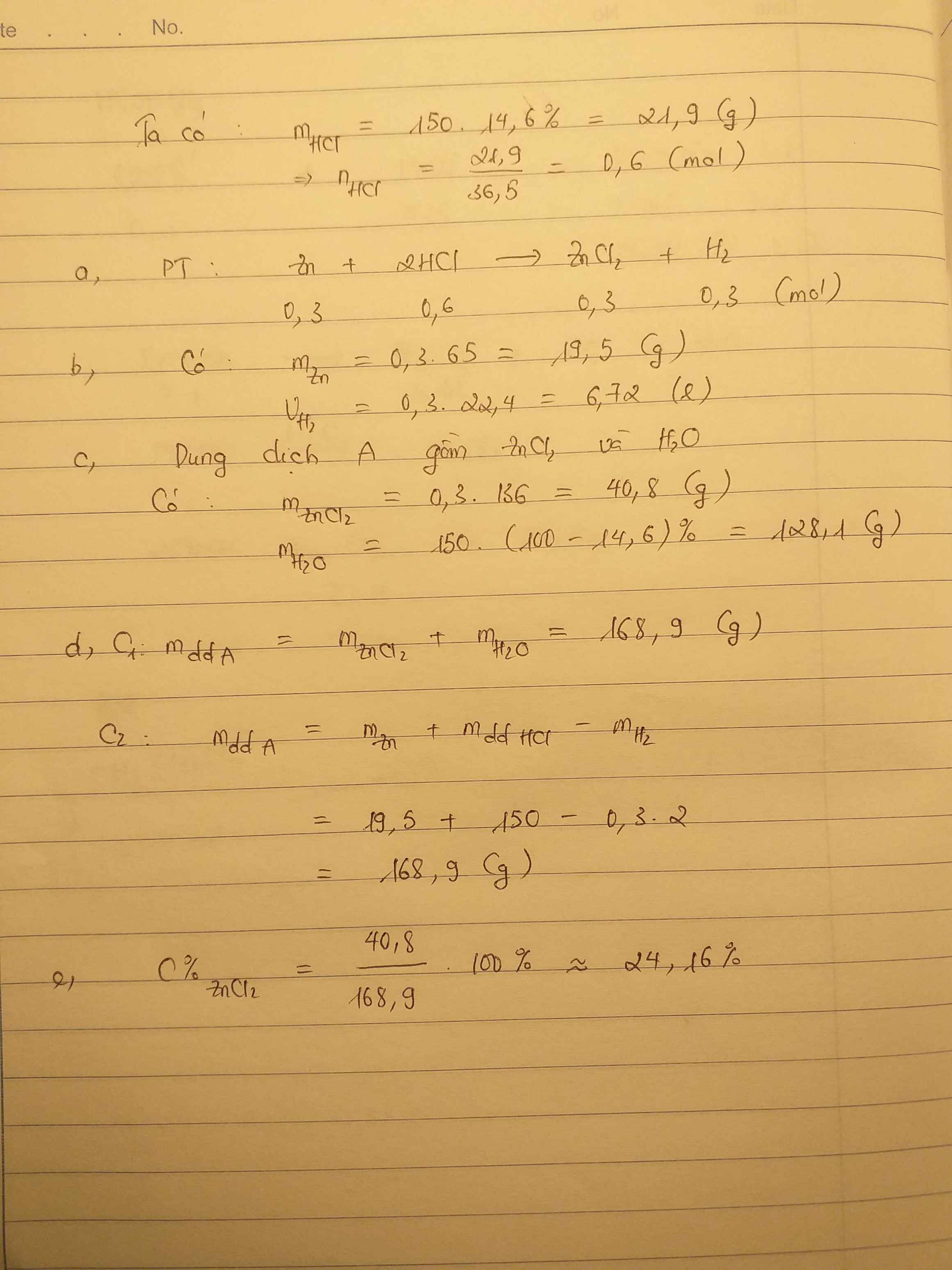
Bài 2:
\(a.n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\\ n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,4}{2}\\ \rightarrow Zndư\\ \rightarrow n_{Zn\left(p.ứ\right)}=n_{H_2}=\dfrac{0,4}{2}=0,2\left(mol\right)\\ \rightarrow n_{Zn\left(dư\right)}=0,4-0,2=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)
b. Sau phản ứng vì Zn dư nên không có phân tử chất nào còn dư.
Bài 1:
\(a.n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\\ PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ Vì:\dfrac{0,3}{1}< \dfrac{0,8}{2}\\ \rightarrow HCldư\\ n_{H_2}=n_{Mg}=0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ n_{HCl\left(dư\right)}=0,8-0,3.2=0,2\left(mol\right)\\ \rightarrow m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)