Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 12,6 (1)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow x+\dfrac{3}{2}y=0,6\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MG}=\dfrac{0,3.24}{12,6}.100\%\approx57,1\%\\\%m_{Al}\approx42,9\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4}=n_{H_2}=0,6\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,3\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{H_2SO_4}=0,6.98=58,8\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{58,8}{14,7\%}=400\left(g\right)\)
Ta có: m dd sau pư = 12,6 + 400 - 0,6.2 = 411,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{0,3.120}{411,4}.100\%\approx8,75\%\\C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{411,4}.100\%\approx8,31\%\end{matrix}\right.\)
Bạn tham khảo nhé!

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
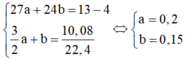
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,3\left(mol\right)=n_{ZnCl_2}\\n_{HCl}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0.3\cdot65}{35,5}\cdot100\%\approx54,93\%\\\%m_{Cu}=45,07\%\\C\%_{HCl}=\dfrac{0,6\cdot36,5}{500}\cdot100\%=4,38\%\\m_{ZnCl_2}=0,3\cdot136=40,8\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{Cu}=35,5-0,3\cdot65=16\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{KL}+m_{ddHCl}-m_{Cu}-m_{H_2}=518,9\left(g\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{40,8}{518,9}\cdot100\%\approx7,86\%\)

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

Mg + 2HCl → MgCl2 + H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
nH2 = 2,8/22,4 = 0,125 mol
Theo tỉ lệ phản ứng (1) => nMg = nH2 = 0,125 mol
<=> mMg = 0,125 .24 = 3 gam và mAl2O3 = 8,1 - 3 =5,1 gam
%mMg = \(\dfrac{3}{8,1}\).100% = 37,03% => %mAl2O3 = 100 - 37,03 = 62,97%
b) nAl2O3 = \(\dfrac{5,1}{102}\)= 0,05 mol
=> nHCl pư = 2nMg + 6nAl2O3 = 0,55 mol
mHCl = 0,55.36,5 = 20,075 gam
=> mdung dịch HCl 18% = \(\dfrac{20,075}{18\%}\)= 111,53 gam

a,
Mg+ 2HCl= MgCl2+ H2
MgO+ 2HCl= MgCl2+ H2O
b,
nH2= 2,24/22,4= 0,1 mol
=> nMg= nMgCl2= 0,5nHCl= 0,1 mol => nHCl= 0,2 mol
=> mMg= 0,1.24= 2,4g
=> mMgO= 2g
c,
nMgO= 2/40= 0,05 mol
=> nMgO= 0,5nHCl= nMgCl2= 0,05 mol
=> nHCl= 0,1 mol
Tổng lượng HCl cần dùng là 0,1+0,2=0,3 mol
=> m dd HCl= 0,3.36,5.100:7,3= 150g

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,2 0,1 (mol)
\(\Rightarrow m_{Mg}=0,1\cdot24=2,4\left(g\right)\)
\(\Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\)\(\Rightarrow n_{MgO}=\dfrac{2}{40}=0,05mol\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,05 0,1
\(\Rightarrow\Sigma n_{HCl}=0,2+0,1=0,3mol\)\(\Rightarrow m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{10,95}{7,3}\cdot100=150\left(g\right)\)
