Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,PTHH:2Mg+O_2\xrightarrow{t^o}2MgO\\ b,BTKL:m_{O_2}=m_{MgO}-m_{Mg}=20-12=8(g)\\ \Rightarrow V_{O_2}=\dfrac{8}{32}.22,4=5,6(l)\\ \Rightarrow V_{kk}=\dfrac{5,6}{\dfrac{1}{5}}=28(l)\)

a, \(2Mg+O_2\underrightarrow{^{t^o}}2MgO\)
\(n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{1}{2}n_{MgO}=0,025\left(mol\right)\Rightarrow V_{O_2}=0,025.22,4=0,56\left(l\right)\)
b, Có lẽ đề cho oxi tác dụng với hidro chứ không phải oxit bạn nhỉ?
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{^{t^o}}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{2}>\dfrac{0,025}{1}\), ta được H2 dư.
THeo PT: \(n_{H_2O}=2n_{O_2}=0,05\left(mol\right)\Rightarrow m_{H_2O}=0,05.18=0,9\left(g\right)\)

a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2. Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2 . 2 = 4 lít.
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit. Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15 . 22,4 = 3,36 lít.
c) Tỉ khối của khí metan và không khí là:
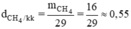
Vậy khí metan nhẹ hơn không khí 0,55.

a) \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
0,15<---0,3<----0,15
b) `m_{O_2} = 0,3.32 = 9,6 (g)`
c) `V_{CH_4} = 0,15.22,4 = 3,36 (l)`

PTHH: 2Mg + O2 → 2MgO nMg = \(\dfrac{7,2}{24}\) = 0,3 (mol)
theo PT: cứ 2 mol Mg tham gia phản ứng tác dụng 1 mol O2
vậy cứ 0,3 mol Mg tham gia phản ứng tạo ra n mol O2
=> nO2 = \(\dfrac{0,3.1}{2}\) = 0,15 (mol)
=> VO2 (đktc) = 0,15 . 22,4 = 3,36 (l)
theo PT: cứ 2 mol Mg tham gia phản ứng tác dụng 2 mol MgO
vậy cứ 0,3 mol Mg tham gia phản ứng tạo ra n mol MgO
=> nMgO = \(\dfrac{0,3.2}{2}\) = 0,3 (mol)
=> mMgO = 0,3 . 40 = 12 (g)
\(\begin{array}{l} PTHH:2Mg+O_2\xrightarrow{t^o} 2MgO\\ n_{Mg}=\dfrac{7,2}{24}=0,3\ (mol)\\ Theo\ pt:\ n_{O_2}=\dfrac{1}{2}n_{Mg}=0,15\ (mol)\\ \Rightarrow V_{O_2}=0,15\times 22,4=3,36\ (l)\\ Theo\ pt:\ n_{MgO}=n_{Mg}=0,3\ (mol)\\ \Rightarrow m_{MgO}=0,3\times 40=12\ (g)\end{array}\)

\(n_{CO_2}=\dfrac{4.4}{44}=0.1\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{^{^{t^0}}}CO_2+2H_2O\)
\(0.1.......0.2........0.1..........0.2\)
\(m_{CH_4}=0.1\cdot16=1.6\left(g\right)\)
\(V_{H_2O}=0.2\cdot22.4=4.48\left(l\right)\)
\(V_{kk}=5V_{O_2}=5\cdot0.2\cdot22.4=22.4\left(l\right)\)
Bài 1 :
a)
Hiện tượng Mg cháy sáng chói
b)
\(2Mg+O_2\rightarrow2MgO\)
c)
\(n_{Mg}=\frac{4,8}{22,4}=0,2\left(mol\right)\)
\(n_{O2}=\frac{0,2}{2}=0,1\left(mol\right)\)
\(\rightarrow V_{O2}=0,1.22,4=2,24\left(l\right)\)
\(n_{MgO}=n_{Mg}=0,2\left(mol\right)\)
\(\rightarrow m_{MgO}=0,2.40=8\left(g\right)\)
Bài 2:
1)
\(M_{CH4}=12+1.4=16\)
\(\frac{dM_{CH4}}{dM_{Kk}}=\frac{16}{29}=0,55\)
\(\rightarrow\) CH4 nhẹ hơn kk 0,55 lần
2)
a)
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
b)
\(n_{CH4}=\frac{17,92}{22,4}=0,8\left(mol\right)\)
\(n_{CO2}=n_{CH4}=0,8\left(mol\right)\)
\(\rightarrow V_{CO2}=0,8.22,4=17,92\left(l\right)\)
c)
\(n_{O2}=0,8.2=1,6\left(mol\right)\)
\(\rightarrow V_{O2}=1,6.22,4=35,84\left(l\right)\)
\(\rightarrow V_{KK}=35,84.5=179,2\left(l\right)\)
Bài 3:
a, \(2Cu+O_2\underrightarrow{^{to}}2CuO\)
b, \(S+O_2\underrightarrow{^{to}}SO_2\)
c, \(3Fe+2O_2\underrightarrow{^{to}}Fe_3O_4\)
d, \(C_2H_4+3O_2\underrightarrow{^{to}}2CO_2+2H_2O\)
e, \(4P+5O_2\underrightarrow{^{to}}2P-2P_2O_5\)
f, \(2Ba+O_2\underrightarrow{^{to}}2BaO\)
g, \(C_3H_6+\frac{9}{2}O_2\underrightarrow{^{to}}3CO_2+3H_2O\)
h, \(4K+O_2\underrightarrow{^{to}}2K_2O\)
i, \(4Al+3O_2\underrightarrow{^{to}}2Al_2O_3\)
j, \(C+O_2\underrightarrow{^{to}}CO_2\)
Bài 4:
Bóng chứa CO2 sẽ rơi xuống
Bóng chứa C2H2 sẽ bay ngang ngang mặt
Bóng chứa H2 sẽ bay lên trời
Vì CO2 nặng hơn không khí,C2H2 gần bằng không khí còn H2 thì nhẹ hơn không khí
Bài 5:
a, Hiện tượng hoá học vì sinh ra khí CO2 là chất mới.
b,
\(BTKL,m_{O2}=4,4-1,2=3,2\left(kg\right)\)
Phương pháp than cháy nhanh hơn: ko ngừng cung cấp oxi cho than cháy, đập nhỏ than.