Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Coi hỗn hợp X thành RCOOH với MRCOOH= 46 + 60 2 = 53
→ MR = 8. nX = 11,13: 53= 0,21 mol
Coi hỗn hợp Y thành R'OH với MR'OH =
32
.
3
+
46
.
2
5
= 37,6
→ MR' = 20,6. nY = 7,52: 37,6 = 0,2 mol
RCOOH + R'OH
→
RCOOR' + H2O
Vì nX > nY thì hiệu suất được tính Y
→ neste = 0,75. 0,2 = 0,15 mol
→ m = 0,15 .( 8 + 44+ 20,6) = 10,89 gam

Đáp án A
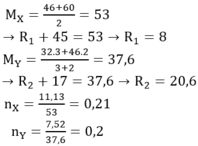
Meste = 0,2. (R1 + 44 + R2).0,75 = 0,2.72,6.0,75 = 10,89g.


⇒ axit dư
n H 2 O = n a x i t p h ả n ứ n g = n a n c o l p h ả n ứ n g = ( 0 , 12 + 0 , 08 ) . 75 % = 0 , 15
n H C O O H p h ả n ứ n g = n C H 3 C O O H p h ả n ứ n g = 0 , 075
n C H 3 C H p h ả n ứ n g = 0 , 09 ; n C 2 H 5 O H p h ả n ứ n g = 0 , 06
Theo định luật bảo toàn khối lượng ta có:
m e s t e = m a x i t + m a n c o l - m H 2 O
Vậy meste = 0,075(46 + 60) + 0,09.32 + 0,06.46 - 0,15.18 = 10,89 (gam)
Đáp án B

Đáp án B
Ta có
n H C O O H = n C H 3 C O O H = 5 , 3 46 + 60 = 0 , 05 ( m o l )
và n C 2 H 5 O H = 0 , 125 ( m o l )
Do hiệu suất của mỗi phản ứng este hóa đều bằng 80% nên ta có
m H C O O C 2 H 5 + m C H 3 C O O C 2 H 5 = ( 74 + 88 ) 80 100 . 0 , 05 = 6 , 48 ( g )

Đáp án : B
Coi HCOOH và CH3COOH là axit RCOOH,
với R = 1 + 15 2 = 8
nRCOOH = 0,1 mol ; nC2H5OH = 0,125 mol
=> neste = 0,1.80% = 0,08 mol
=> mRCOOC2H5 = 0,08.(8 + 44 + 29) = 6,48 g
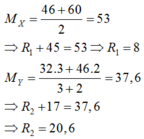
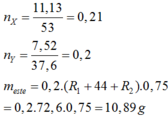
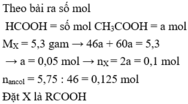
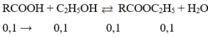


xét ở th H=100%
6.4=n(12*2+3+12+32+1)+2n*(12+3+12+1)
=>n=1/30
n \(H_2O\)= n\(CH_3COOH\)/2+n\(C_2H_3COOH\)/2 +n\(C_2H_5OH\)/2
=\(\dfrac{1}{15\cdot2}+\dfrac{1}{30\cdot2}+\dfrac{0,125}{2}=0,1125mol\)
=> m este =6,4 +0,125*M\(C_2H_5OH\) -0,1125*18
=10,125 g
vậy khi hiệu xuất 80% thì m= 10.125*80/100=8,1g
nếu tôi làm sai thì vào đâyHóa Học Hay - Posts
đáp số sai b