Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn khối lượng :
\(m_{O_2}=44.6-28.6=16\left(g\right)\)
\(n_{O_2}=\dfrac{16}{32}=0.5\left(mol\right)\)
Bảo toàn O :
\(n_{H_2O}=2n_{O_2}=2\cdot0.5=1\left(mol\right)\)
Bảo toàn H :
\(n_{HCl}=2\cdot n_{H_2O}=2\cdot1=2\left(mol\right)\)
\(V_{dd_{HCl}}=\dfrac{2}{1}=2\left(l\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=44.6+2\cdot36.5-1\cdot18=99.6\left(g\right)\)
\(n_O=\dfrac{44,6-28,6}{16}=1\left(mol\right)\)
\(n_{HCl}=n_{Cl^-}=n_O=2\left(mol\right)\)
\(m_{muối}=m_{KL}+m_{Cl^-}=28,6+2.35,5=99,6\left(g\right)\)
\(V_{HCl}=\dfrac{2}{1}=2\left(l\right)\)

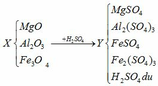
(a) Hòa tan MgO, Al2O3 và Fe3O4 vào H2SO4:
(1) MgO + H2SO4 → MgSO4 + H2O
(2) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
(3) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
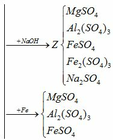
Trung hòa Y:
(4) H2SO4 + 2NaOH → Na2SO4 + 2H2O
Cho dung dịch Y (MgSO4, Al2(SO4)3, FeSO4, Fe2(SO4)3, H2SO4) qua cột chứa bột sắt:
(5) H2SO4 + Fe → FeSO4 + H2
(6) Fe2(SO4)3 + Fe → 3FeSO4
(b) nH2SO4 = 0,45.1 = 0,45 mol
Gọi số mol của MgO, Al2O3 và Fe3O4 trong hỗn hợp ban đầu lần lượt là x, y, z (mol)
Ta có: 40x + 102y + 232z = 20,68 (*)
- Khi hòa tan hỗn hợp vào H2SO4:
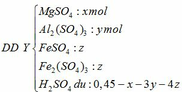
- Trung hòa ¼ dung dịch Y cần 0,025 mol NaOH vậy trung hòa Y cần 0,1 mol NaOH:
Theo PTHH (4): nH2SO4 dư = 0,5nNaOH = 0,05 mol
=> 0,45 – x – 3y – 4z = 0,05
=> x + 3y + 4z = 0,4 (**)
Dung dịch thu được chứa các chất:
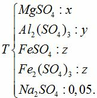
- Giả sử dẫn toàn bộ dung dịch Y qua cột chứa bột Fe:
(5) H2SO4 + Fe → FeSO4 + H2
0,05 → 0,05 (mol)
(6) Fe2(SO4)3 + Fe → 3FeSO4
z → 3z (mol)
Dung dịch sau chứa các chất tan:
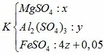
Theo đề bài ta có: mK – mT = 4.1,105
=> [120x + 342y + 152(4z + 0,05)] – [120x + 342y + 152.z + 400z + 0,05.142] = 4,42
=> z = 0,07 (***)
Từ (*) (**) (***) ta giải được z = 0,06; y = 0,02; z = 0,07
Số mol của nguyên tố O trong hỗn hợp X:
nO = nMgO + 3nAl2O3 + 4nFe3O4 = 0,06 + 3.0,02 + 4.0,07 = 0,4 mol
Khối lượng của O: mO = 0,4.16 = 6,4 (gam)
Phần trăm khối lượng của nguyên tố O:


Áp dụng tăng giảm khối lượng, ta thấy 1 nguyên tử O được thay thế bởi 2 nguyên tử Cl.
ZnO, PbO, NiO → Z n C l 2 , P b C l 2 , N i C l 2
⇒ Từ 1 mol oxit ban đầu khối lượng muối sau phản ứng tăng là:
m↑= m 2 C l - m O = 2.35,5 - 16 = 55g
m h h b a n d a u = m F e 3 O 4 + m C u p ư = , 12 . 232 + 0 , 12 . 64 + 8 , 32 = 43 , 84 g
Theo bài ra, ta có:
m↑ = m m u o i - m h h o x i t = (b +55) - b = 55g
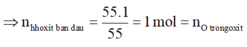
⇒mX = m h h o x i t b a n d a u - m O =b-16 = a
⇒ Chọn A.

\(a.\\ m+m_{\left[O\right]}=16,2\\ n_{Cl^-}=2\dfrac{m_{\left[O\right]}}{16}\\ m+35,5\dfrac{m_{\left[O\right]}}{16}\cdot2=38,2\\ m=9,8;m_{\left[O\right]}=6,4\\ b.\\ V_{dd.acid}=v\left(L\right)\\ n_{H^+}=v+v=2v\left(mol\right)\\ n_{\left[O\right]}=\dfrac{6,4}{16}=0,4=\dfrac{2v}{2}\\ v=0,4\\ a=9,8+0,4\cdot35,5+0,4\cdot96=62,4g\)
`a)`
Bảo toàn KL:
`m_Y+m_{HCl}=m_{\text{muối}}+m_{H_2O}`
`->36,5n_{HCl}-18n_{H_2O}=38,2-16,2=22`
Mà bảo toàn H: `n_{HCl}=2n_{H_2O}`
`->n_{HCl}=0,8(mol);n_{H_2O}=0,4(mol)`
Bảo toàn O: `n_{O(Y)}=n_{H_2O}=0,4(mol)`
`->n_{O_2}=0,5n_{O(Y)}=0,2(mol)`
Bảo toàn KL: `m_X+m_{O_2}=m_Y`
`->m=16,2-0,2.32=9,8(g)`
`b)`
Đặt `V_{dd\ ax it}=x(l)`
`->n_{HCl}=x(mol);n_{H_2SO_4}=0,5x(mol)`
`n_{O(Y)}=0,4(mol)`
Bảo toàn electron: `n_{O(Y)}=1/2n_{H(ax it)}`
`->0,4=1/2(x+0,5x.2)`
`->x=0,4(l)`
`->n_{HCl}=0,4(mol);n_{H_2SO_4}=0,2(mol)`
Bảo toàn O: `n_{H_2O}=n_{O(Y)}=0,4(mol)`
Bảo toàn KL:
`m_Y+m_{HCl}+m_{H_2SO_4}=m_{\text{muối}}+m_{H_2O}`
`->a=16,2+0,4.36,5+0,2.98-0,4.18=43,2(g)`

a, \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{Fe_2O_3}=y\left(mol\right)\end{matrix}\right.\) ⇒ 80x + 160y = 32 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{CuCl_2}=n_{Cu}=x\left(mol\right)\\n_{FeCl_3}=2n_{Fe_2O_3}=2y\left(mol\right)\end{matrix}\right.\) ⇒ 135x + 325y = 59,5 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,2.80=16\left(g\right)\\m_{Fe_2O_3}=0,1.160=16\left(g\right)\end{matrix}\right.\)
c, Theo PT: \(n_{HCl}=2n_{CuO}+6n_{Fe_2O_3}=1\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{1}{0,5}=2\left(l\right)\)

