K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

NV
21 tháng 2 2017
Đó là nồng độ mol, mình pha loãng ra từ HCl 36.46% để cho vào Fe2O3

10 tháng 2 2017
Đáp án C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có:
Fe3O4 +4H2SO4 → FeSO4 +Fe2(SO4)3 +4H2O
0,02 0,02
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 l

29 tháng 11 2019
Đáp án B
Lời giải chi tiết
Để trung hòa ½ dung dịch X cần 0,02 mol HCl nên số mol OH- trong X là 0,04 mol hay a=0,04
Bảo toàn điện tích: b = 0,04 + 0,01 - 0,01.2 = 0,03
=> m = 0,01.137 + 0,01.62 + 0,04.17 + 0,03.23 = 3,36 gam

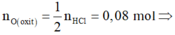
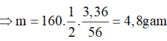

Fe2O3 + 6HCl ----> 2FeCl3 + 3H2O
nFe2O3 = 3,75 (mol)
theo pthh nHCl = 6.nFe2O3
= 6.3,75
= 22,5 (mol)
Vậy thể tích axit clohidric can dung để hòa tan hết lượng Sắt III oxit trên la
=> VHCl (đktc) = 22,5 . 22,4 = 504 (l)
= 504 000 (ml)