Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2. Trong các phản ứng sau phản ứng nào chứng tỏ clo vừa là chất oxihoa, vừa là chất khử ?
A. CL2+H2O+SO2 ---> 2HCl+ H2SO4
B. Cl2 + H2O <----> HCl+HClO
C.2Cl+2H2O <----> 4HCl + O2
D. Cl2 + H2 <----> 2HCl
3.Tìm câu nhận định sai trong các câu sau ?
A. Clo có tác dụng là dd kiềm
B. Clo có tính chất đặc trưng là tính khử
C. Clo là phi kim rất hoạt động, có tính oxi hóa mạnh, trong một số phản ứng clo thể hiện tính khử
D. Có thể điều chế được các hợp chất của clo, trong đó số oxi hóa của clo là -1, +1, +3, +5, +7.
4. Sục một lượng khí clo vừa đủ vào dung dịch hỗn hợp của NaI và NaBr, chất được giải phóng là:
A. Cl2 và Br2
B. I2
C. Br2
D. I2 và B2
5.Sắt tác dụng với chất nào dưới đây cho sắt(III)clorua?
A.HCl B. Cl2 C. NaCl D. CuCl2
6. Clorua vôi được sử dụng nhiều hơn nước Gia-ven vì:
A. Clorua vôi rẻ tiền hơn
B. Clorua vôi có hàm lượng hipoclorit cao hơn
C. Clorua vôi dễ bảo quản và dễ chuyên chở hơn
D. Cả A, B và C
7. Khi mở một lọ đựng dung dịch axit HCl 37% trong không khí ẩm, thấy có khối trắng bay ra. Khói đó là do
A. HCl phân hủy tạo thành H2 và Cl2
B. HCl dễ bay hơi tạo thành
C. HCl dễ bay hơi, hút ẩm tạo ra các giọt nhỏ axit HCl
D. HCl đã tan trong nước đến mức bão hòa
8. Khí hiđroclorua có thể được điều chế bằng cách cho muối ăn (NaCl rắn) tác dụng với chất nào sau đây?
A. NaOH B. H2SO4 đặc C.H2SO4 loãng D. H2O

Câu 1:
2Al+ 6HCl---->2AlCl3+3H2
x-----3x----------------x----1,5x
Zn+2HCl----->ZnCl2+H2
y------2y------------y-----y
n HCl=0,4.2=0,8(mol)
Theo bài ta có hpt
\(\left\{{}\begin{matrix}27x+65y=11,9\\3x+2y=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
m AlCl3=0,2.133,5=26,7(g)
m ZnCl2=0,1.136=13,6(g)
b) Theo pthh
n H2=1/2n HCl=0,4(mol)
V H2=0,4.22,4=8,96(l)
c) m muối=26,7+13,6=40,3(g)
2)
a) MnO2+4HCl---->Cl2+2H2O+MnCl2
Cl2+ 2NaOH---->H2O+NaCl+NaClO
b)
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng mk ghi lại cho dễ nhìn nha
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =\(\frac{0,8}{0,5}\)= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
3) 
Chúc bạn học tốt

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
x R 4 5 6 7 12 có C 18,14 loại 24,28 loại 30,42 loại
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron C : H : H : H : H ; Công thức cấu tạo C - H - - - H H H
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
a ơi nhưng trong đề của cô e cho 4 đáp án không có đáp án 63,15%

a.
CnH2n+H2Ni,to⟶CnH2n+2CmH2m−2+2H2Ni,to⟶CmH2m+2{CnH2n:xCmH2m−2:y→{x+y=100x+2y=160→{x=40y=60→%mol=%V{40%60%CnH2n+H2⟶Ni,toCnH2n+2CmH2m−2+2H2⟶Ni,toCmH2m+2{CnH2n:xCmH2m−2:y→{x+y=100x+2y=160→{x=40y=60→%mol=%V{40%60%
b.
Khi cho NaOH dư vào thu thêm được kết tủa nên dung dịch có muối Ca(HCO3)2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,5 ← 0,15
2CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
0,1 ← 0,1
→ nCO2 = 0,1.2 + 0,5 = 0,7
Mặt khác: mdd giảm = mCaCO3 – mCO2 + mH2O
→ 9,12 = 50 – (44.0,7 + 18.nH2O) → nH2O = 0,56
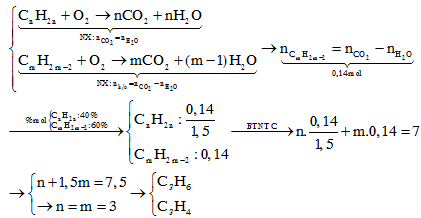

Công thức chung Ankan: CnH2n+2
Ta có:
\(\%_H=16,28\%\)
\(\Leftrightarrow\frac{2n+2}{12n+2n+2}=16,28\%\)
\(\Rightarrow n=2\)
Vậy Ankan là C6H14
Đáp án đúng là D
Hexan sẽ có 3 sản phẩm thế
2,3-đimetylbutan sẽ có 2 sản phẩm thế
2-metyl pentan sẽ có 5 sản phẩm thế