Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức muối cacbonat cần tìm là MCO3
giả sử có 1 mol H2SO4 phản ứng
MCO3 + H2SO4 ---> MSO4 + CO2 + H2O
1 <--- 1 --> 1 1
m H2SO4 = 1.98 = 98g---> m dung dịch H2SO4 = (98 . 100)/ 16 = 612,5 g
m MCO3 = M + 60
m CO2 = 1. 44=44 g
m dds pứ = mMCO3 + mH2SO4 - m CO2
= M + 60 + 612,5 - 44
= M + 628,5 g
C% = ( m MSO4 / m dds pứ ) .100= 22,2%
hay ( M+96 / 628,5) .100 = 22,2%
--> M = 56 (1)
và M là hóa trị 2 (2)
---> M là sắt ( Fe = 56 , hóa trị 2)
---> công thức phân thức của muối là FeCO3
Gọi M là kim loại cần tìm
vì chất khí không thoát ra, vẫn còn chất rắn không tan, muối sunphat tan => H2SO4 hết, muối cacbonet còn dư
Giả sử có 1 mol axit phản ứng
MCO3 + H2SO4 --> MSO4 + H2O + CO2
1 <------ 1 --------> 1 --------------> 1
khối lượng muối sunphat = (M+96).1
khối lượng dd sau phản ứng = khối lượng dd axit + khối lượng muối cacbonat đã phản ứng - khối lượng CO2 thoát ra = 1.98.100/14,7 + (M+60).1 - 1.44 = M + 682,67
C% muối sunphat = %
=> M = 24 => M là Mg

Gọi CT oxit : \(R_2O_x\)
Ta có \(n_{R_2O_x}=\dfrac{3,2}{2R+16x}\left(mol\right)\)
PTHH: \(R_2O_x+xH_2SO_4\rightarrow R_2\left(SO_4\right)_x+xH_2O\) (1)
\(\dfrac{3,2}{2R+16x}\)---->\(\dfrac{3,2}{2R+16x}.x\)-->\(\dfrac{3,2}{2R+16x}\) (mol)
\(H_2SO_{4\left(dư\right)}+CaCO_3\rightarrow CaSO_4+CO_2+H_2O\) (2)
\(n_{CO_2}=\dfrac{0,244}{22,4}=0,01\left(mol\right)\)
Theo PT (2) : \(n_{CO_2}=n_{CaSO_4}=n_{H_2SO_4dư}=0,01\left(mol\right)\)
Ta có : \(m_{muối}=\text{}\dfrac{3,2}{2R+16x}.\left(2R+96x\right)+0,01.136=9,36\left(g\right)\)
\(\dfrac{3,2}{2R+16x}\).(2R+96x)=8
Lập bảng :
| x | 1 | 2 | 3 |
| R | 18,67 | 37,33 | 56 |
| Kết luận | Loại | Loại | Chọn (Fe) |
=> Oxit là Fe2O3
\(\Sigma n_{H_2SO_4}=0,02.3+0,01=0,07\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,07.98}{200}.100=3,43\%\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

PTHH: MCl2 + 2AgNO3 → M(NO3)2 + 2AgCl ↓
Theo pt: Số mol MCl2 = Số mol M(NO3)2
Mà: Khối lượng mol của MCl2 < Khối lượng mol của M(NO3)2 => Khối lượng muối M(NO3)2 hơn khối lượng muối ban đầu là 1,59(gam).
Khối lượng muối M(NO3)2 sau phản ứng là:
3,33 + 1,59 = 4,92 (gam)
Số mol MCl2 tính theo khối lượng là:
3,33 / MM + 71
Số mol M(NO3)2 tính theo khối lượng là:
4,92 / MM + 124
Mà: Số mol của 2 muối là bằng nhau
=> 3,33 / MM + 71 = 4,92 / MM + 124
=> MM = 40 ( Canxi )
=> Công thức hoá học của muối Clorua kim loại M là: CaCl2

3,2 gam chất rắn không tan là Cu => mCu = 3,2 (g)
=> mR = 4,9 - 3,2 = 1,7 (g)
Gọi hóa trị của R là n => \(n_R=\dfrac{1,7}{M_R}\)
PTHH: 2R + 2nHCl ---> 2RCln + nH2
\(\dfrac{1,7}{M_R}\)--------------->\(\dfrac{1,7}{M_R}\)
=> \(\dfrac{1,7}{M_R}=\dfrac{4,44}{M_R+35,5n}\)
=> MR = 22,025n (g/mol)
Không có giá trị của n nào thỏa mãn
=> Không có kim loại R nào thỏa mãn yêu cầu của bài ra

a) CTHH: R2O3
\(m_{H_2SO_4}=\dfrac{294.20}{100}=58,8\left(g\right)=>n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
PTHH: R2O3 + 3H2SO4 --> R2(SO4)3 + 3H2O
_______0,2<------0,6---------->0,2_________________(mol)
=> \(M_{R_2O_3}=\dfrac{32}{0,2}=160\left(g/mol\right)=>M_R=56\left(Fe\right)\)
b) \(m_{Fe_2\left(SO_4\right)_3}=0,2.400=80\left(g\right)\)

Câu 1
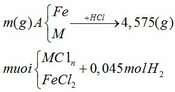
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
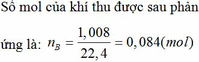
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
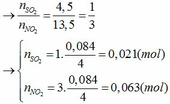
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
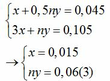
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

a/ CT oxit: $CuO$
b/ Vậy CT X: $CuSO_4.5H_2O$
Giải thích các bước giải:
Gọi công thức oxit là: $MO$
Số mol oxit là a mol
$MO+H_2SO_4\to MSO_4+H_2O$
Theo PTHH
$n_{H_2SO_4}=n_{MSO_4}=n_{MO}=a\ mol$
$⇒m_{dd\ H_2SO_4}=\dfrac{98a.100}{24,5}=400a$
$⇒m_{dd\ A}=a.(M+16)+400a = aM+416a$
$m_{MSO_4}=a.(M+96)$
Do nồng độ muối là 33,33% nên:
$\dfrac{a.(M+96)}{aM+416a}.100\%=33,33\\⇒M=64$
Vậy M là Cu, công thức oxit: $CuO$
b.
Trong 60 gam dung dịch muối A có:
$m_{CuSO_4}=\dfrac{60.33,33}{100}=20g$
Gọi công thức tinh thể tách ra là: $CuSO_4.nH_2O$
Khối lượng dung dịch còn lại là:
$60-15,625=44,375g ⇒ m_{CuSO_4\ trong\ dd}=\dfrac{44,375.22,54}{100}=10g$
$⇒m_{CuSO_4\ trong\ tinh\ thể}=20-10=10g$
$⇒n_{tinh\ thể}=n_{CuSO_4}=0,0625\ mol$
$⇒M_{tinh\ thể}=15,625:0,0625=250⇒n=5$
Vậy CT X: $CuSO_4.5H_2O$


vì chất khí không thoát ra, vẫn còn chất rắn không tan, muối sunphat tan => H2SO4 hết, muối cacbonet còn dư
Giả sử có 1 mol axit phản ứng
MCO3 + H2SO4 --> MSO4 + H2O + CO2
1 <------ 1 --------> 1 --------------> 1
khối lượng muối sunphat = (M+96).1
khối lượng dd sau phản ứng = khối lượng dd axit + khối lượng muối cacbonat đã phản ứng - khối lượng CO2 thoát ra = 1.98.100/14,7 + (M+60).1 - 1.44 = M + 682,67
C% muối sunphat = (M+96)/(M+682.67)*100% = 17%
=> M = 24 => M là Mg b) Gọi công thức muối hiđrat là:FeCl2.xH2O --->mFeCl2.xH2O = 24,3(g)
trong dung dịch bão hòa ban đầu: mFeCl2 = 40*38,5% = 15,4g
Vì dung dịch ban đầu đã bão hòa nên 10g FeCl2 thêm vào sau khi đưa về nhiệt độ cũ sẽ kết tinh
Khi đưa về nhiệt độ ban đầu thì khối lượng dung dịch = 40 + 10 - 24,3 = 25,7
----->mFeCl2 = 25,7*38,5% = 9,8945
----->mFeCl2(trong tinh thể) = 10 + 15,4 - 9,8945 =15,5055
------->nFeCl2 = 15,5055/127 = 0,122 mol
----->nFeCl2.xH2O = nFeCl2 = 0,122mol
----->MFeCl2.xH2O = 24,3/0,122 = 199
------->127 + 18x = 199 ------>x = 4
Vậy công thức muối hidrat là : FeCl2.4H2O
tại sao n FeCl2.xH2O = nFeCl2