Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A:nguyên tố F,ô 9,nhóm VIIA,chu kì 2
B:nguyên tố Cl,ô 17,nhómVIIA,chu kì 3

Gọi \(Z_X,Z_Y\) là điện tích của hạt nhân X,Y.
Tổng điện tích hạt nhân : \(Z_X+Z_Y=52\)(1)
X và Y thuộc hai chu kì liên tiếp nên xảy ra 2 trường hợp:
\(\left[{}\begin{matrix}Z_X-Z_Y=8\\Z_X-Z_Y=18\end{matrix}\right.\)
TH1: \(Z_X-Z_Y=8\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}Z_X=30\\Z_Y=22\end{matrix}\right.\)
\(X\left(Z=30\right):\left[Ar\right]3d^{10}4s^2\)\(\Rightarrow\)X nằm ở ô thứ 30, chu kì 4 nhóm llB.
\(Y\left(Z=22\right):\left[Ar\right]3d^24s^2\)\(\Rightarrow\) Y nằm trong ô thứ 22, chu kì 4 nhóm lllB.
Vậy TH này loại vì cùng thuộc 1 chu kì.
TH2: \(Z_X-Z_Y=18\) (3)
Từ (1) và (3) \(\Rightarrow\left\{{}\begin{matrix}Z_X=35\\Z_Y=17\end{matrix}\right.\)
\(X\left(Z=35\right):\left[Ar\right]3d^{10}4s^24p^5\)\(\Rightarrow\)X nằm trong ô thứ 35, chu kì 4 nhóm VllA.
\(Y\left(Z=17\right):\left[Ne\right]3s^23p^5\)\(\Rightarrow\) Y nằm trong ô thứ 17 chu kì 3 nhóm VllA.
Vậy TH này thỏa mãn ycbt.

a) Vì A và B là 2 nguyên tố thuộc 2 chu kì nhỏ liên tiếp và 2 nhóm liên tiếp trong bảng tuần hoàn.
Tổng số hiệu nguyên tử 4 < Z < 32
=> A, B sẽ thuộc các chu kỳ nhỏ
=> \(\left[{}\begin{matrix}\left\{{}\begin{matrix}Z_A+Z_B=19\\\left|Z_A-Z_B\right|=7\end{matrix}\right.\\\left\{{}\begin{matrix}Z_A+Z_B=19\\\left|Z_A-Z_B\right|=9\end{matrix}\right.\end{matrix}\right.\)
=> \(\left[{}\begin{matrix}\left\{{}\begin{matrix}Z_A=5\left(B\right)\\Z_B=14\left(Si\right)\end{matrix}\right.\\\left\{{}\begin{matrix}Z_A=6\left(C\right)\\Z_B=13\left(Al\right)\end{matrix}\right.\end{matrix}\right.\)
Gọi mang điện của A là p
Suy ra số hạt mang điện của B là : p + 1 + 8 = p + 9
Ta có :
$p + p + 9 = 19 \Rightarrow p = 5$
Vậy 2 nguyên tố A,B là Bo và Silic
A : ô 5 nhóm IIIA chu kì 2
B : ô 14 nhóm IVA chu kì 3
b)
Gọi CTHH của X là $B_nA_m$
Gọi số proton của B là p
Suy ra số proton của A là p - 8 + 1 = p - 7
Ta có :
pn + (p -7)m = 70
Với n = 4 ; m = 3 thì p = 13
Suy ra X là $Al_4C_3$

Chu kì 1 có 2 nguyên tố.
Chu kì 2 và 3 đều có 8 nguyên tố. Hai nguyên tố cùng thuộc phân nhóm chính ở chu kì 2 và 3 có số đơn vị điện tích hạt nhân hơn kém nhau là 8.
Chu kì 3 có 3 nguyên tố và chu kì 4 có 18 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 3 và 4 có số đơn vị điện tích hạt nhân hơn kém nhau là 8 hoặc 18.
Chu kì 4 và 5 đều có 18 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 4 và 5 có số đơn vị điện tích hạt nhân hơn kém nhau là 18.
Chu kì 5 có 18 nguyên tố, chu kì 6 có 32 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 5 và 6 có số đơn vị điện tích hạt nhân hơn kém nhau là 18 hoặc 32.
Chu kì 6 có 32 nguyên tố, chu kì 7 đang hoàn thiện có 32 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 6 và 7 có số đơn vị điện tích hạt nhân hơn kém nhau 32.

Đáp án:A
Chu kì 1 có 2 nguyên tố.
Chu kì 2 và 3 đều có 8 nguyên tố. Hai nguyên tố cùng thuộc phân nhóm chính ở chu kì 2 và 3 có số đơn vị điện tích hạt nhân hơn kém nhau là 8.
Chu kì 3 có 3 nguyên tố và chu kì 4 có 18 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 3 và 4 có số đơn vị điện tích hạt nhân hơn kém nhau là 8 hoặc 18.
Chu kì 4 và 5 đều có 18 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 4 và 5 có số đơn vị điện tích hạt nhân hơn kém nhau là 18.
Chu kì 5 có 18 nguyên tố, chu kì 6 có 32 nguyên tố. Nếu hai nguyên tố đều thuộc một phân nhóm chính ở chu kì 5 và 6 có số đơn vị điện tích hạt nhân hơn kém nhau là 18 hoặc 32.
Chu kì 6 có 32 nguyên tố, chu kì 7 đang hoàn thiện có 32 nguyên tố. Nếu hai nguyên tố đều thuộc phân nhóm chính ở chu kì 6 và 7 có số đơn vị điện tích hạt nhân hơn kém nhau là 32.
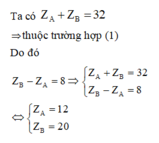
Chọn C