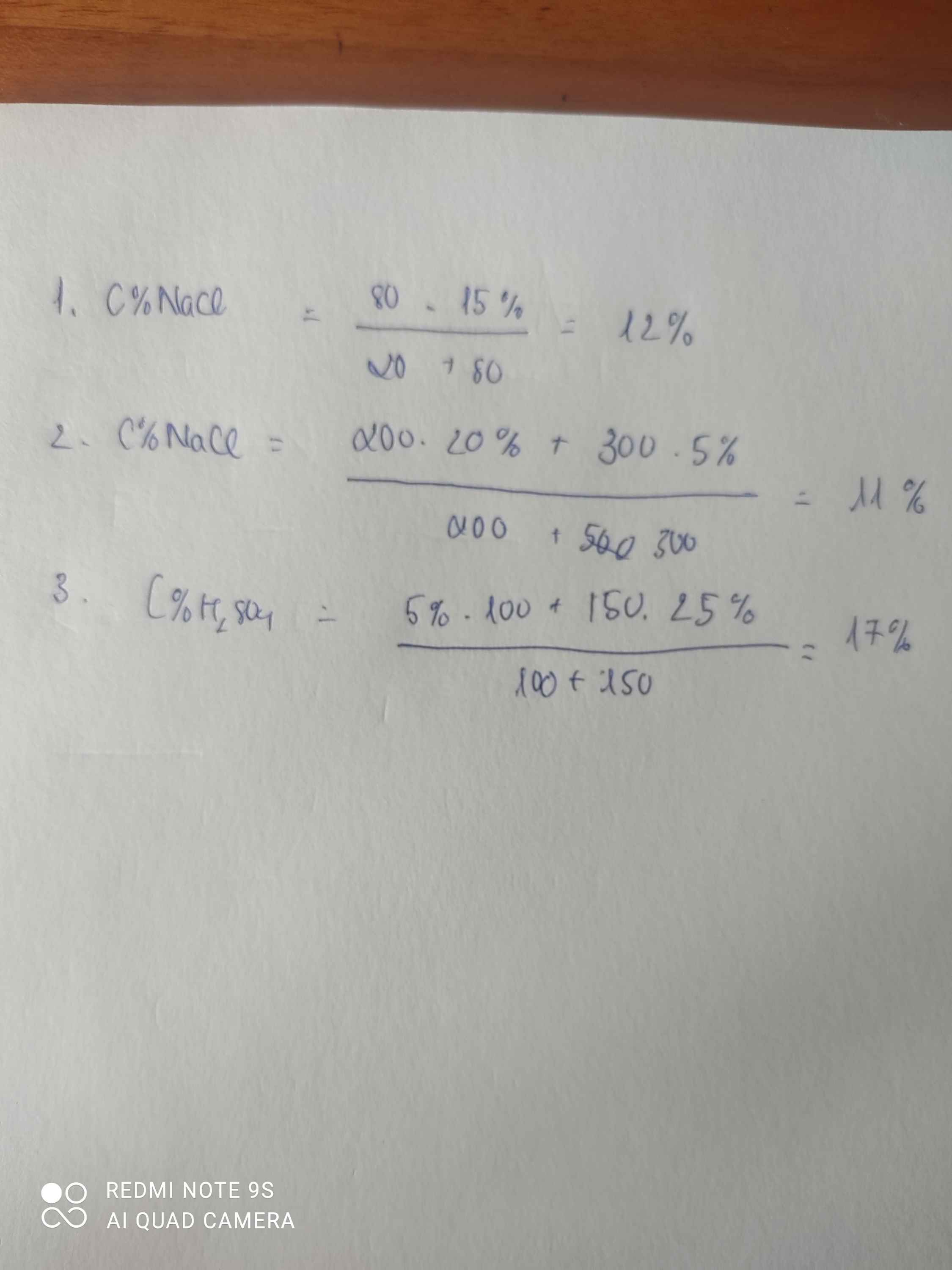Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


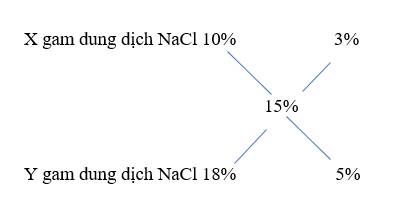
Ta có: m1 + m2 = 150 (1)
mNaNO3 (10%) = m1.10% (g)
mNaNO3 (2,5%) = m2.2,5% (g)
⇒ m1.10% + m2.2,5% = 150.5% (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}m_1=50\left(g\right)\\m_2=100\left(g\right)\end{matrix}\right.\)

m1 = \(\dfrac{80\times10}{100}=8\left(g\right)\)
m2 = \(\dfrac{20\times20}{100}=4\left(g\right)\)
C% dd thu được = \(\dfrac{8+4}{80+20}.100\%=12\%\)

1)
$m_{dd} = 50 + 30 = 80(gam)$
$m_{KOH} = 50.20\% + 30.15\% = 14,5(gam)$
$C\% = \dfrac{14,5}{80}.100\% = 18,125\%$
2)
$m_{dd} = 200 + 300 = 500(gam)$
$m_{NaCl} = 200.20\% + 300.5\% = 55(gam)$
$C\% = \dfrac{55}{500}.100\% = 11\%$

a) Số gam chất tan có trong 500g dd HCl 3% là:
\(m_{HCl}=\dfrac{500.3}{100}=15\left(g\right)\)
Số gam chất tan có trong 300g dd HCl 10%:
\(m_{HCl}=\dfrac{300.10}{100}=30\left(g\right)\)
Nồng độ phần trăm dd axit mới:
\(C\%_{ddHCl\left(mới\right)}=\dfrac{15+30}{500+300}.100=5,625\%\)
a) - Khối lượng HCl trong 500 gam dung dịch 3% : \(\dfrac{500\cdot3}{100}\)
- Khối lượng HCl trong 300 gam dung dịch 10% : \(\dfrac{300\cdot10}{100}\)
- Tính theo công thức tính nồng độ phần trăm :
\(\dfrac{\left[\left(\dfrac{500\cdot3}{100}\right)+\left(\dfrac{300\cdot10}{100}\right)\right]\cdot100\%}{\left(500+300\right)}=5,625\%\)
b) Khối lượng NaCl trong 1800 gam dung dịch 30%
\(\dfrac{1800\cdot30}{100}=540\left(g\right)\)
Khối lượng nước : 1800 - 540 = 1260 ( g )
Khối lượng muối tan bão hòa trong 1260 gam nước ở 20oC :
\(\dfrac{36\cdot1260}{100}=453,6\left(g\right)\)
Lượng muối kết tinh : 540 - 453,6 = 86,4 ( g )

mNaOH = 200.10% = 20 gam ➝ nNaOH = 0,5 mol
nH2SO4 = 0,1 mol, nMgSO4 = 0,2 mol
Phản ứng:
(1) 2NaOH + H2SO4 ➝ Na2SO4 + 2H2O
0,2 0,1 0,1 (mol)
(2) 2NaOH + MgSO4 ➝ Mg(OH)2 + Na2SO4
0,3 0,15 0,15 0,15 (mol)
Dung dịch X: Na2SO4: 0,25 mol, MgSO4 dư: 0,05 mol
Kết tủa Mg(OH)2: 0,15 mol
Mg(OH)2 ➝ MgO + H2O
0,15 0,15
m1 = 0,15.58 = 8,7 gam
m2 = 0,15.40 = 6 gam

\(Na+H_2O->NaOH+\dfrac{1}{2}H_2\\ a.n_{Na}=\dfrac{m_1}{23}\left(mol\right)\\ m_{ddsau}=\dfrac{m_1}{23}+m_2-\dfrac{m_1}{46}=\dfrac{m_1}{46}+m_2\left(g\right)\\ C\%_B=\dfrac{\dfrac{40}{23}m_1}{\dfrac{m_1}{46}+m_2}\cdot100\%.\\ b.C_M=\dfrac{10dC\%}{M}=10\cdot1,2\cdot\dfrac{0,05}{40}=0,015\left(M\right)\)
\(Na+H_2O->NaOH+\dfrac{1}{2}H_2\\ a.n_{Na}=\dfrac{m_1}{23}\left(mol\right)\\ m_{ddsau}=m_1+m_2-\dfrac{m_1}{23}=\dfrac{22}{23}m_1+m_2\left(g\right)\\ C\%_B=\dfrac{\dfrac{40}{23}m_1}{\dfrac{22}{23}m_1+m_2}\cdot100\%.\\ b.C_M=\dfrac{10dC\%}{M}=10\cdot1,2\cdot\dfrac{0,05}{40}=0,015\left(M\right)\)