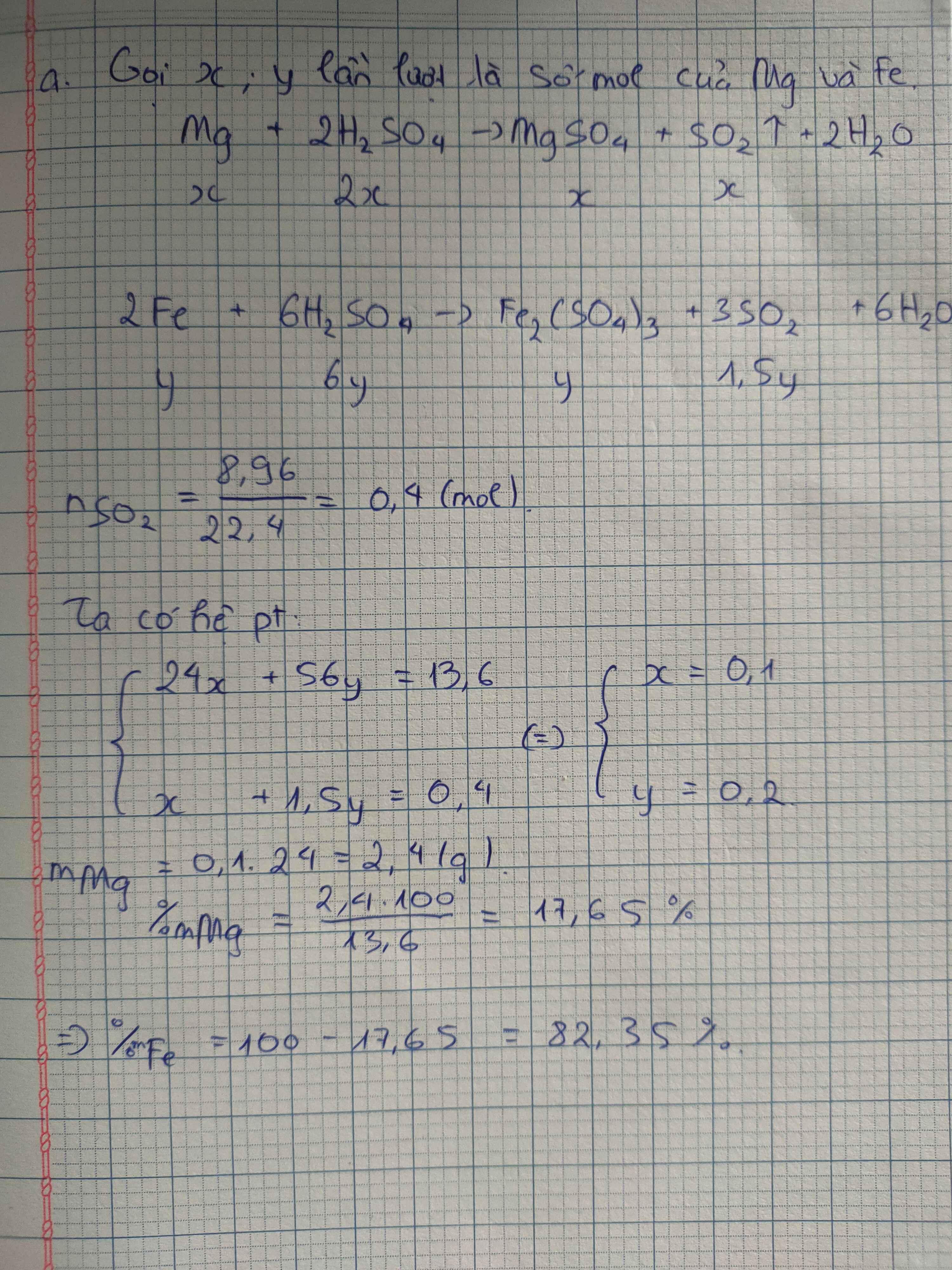Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
\(PTHH:2NaOH+H_2S\rightarrow Na_2S+2H_2O\)
_________________0,05______0,05____________
\(NaOH+H_2S\rightarrow NaHS+H_2O\)
_________0,1 ______0,1________
\(\Rightarrow\Sigma n_{H2S}=0,1+0,05=0,15\left(mol\right)\)
\(\Rightarrow V_{H2S}=0,15.22,4=3,36\left(l\right)\)
Câu 2:
Ta có:
\(n_{NaOH}=0,35.0,1=0,035\left(mol\right)\)
\(n_{H2S}=\frac{0,448}{22,4}=0,02\left(mol\right)\)
\(\Rightarrow T=\frac{n_{NaOH}}{n_{H2S}}=\frac{0,035}{0,02}=1,75\)
\(1< T< 2\Rightarrow\) Tạo cả 2 muối
\(2NaOH+H_2S\rightarrow Na_2S+2H_2O\)
0,035_____0,0175___0,0175_____ \(Na_2S+H_2S\rightarrow2NaHS\) 0,0025___0,0025___0,005 \(\Rightarrow\left\{{}\begin{matrix}CM_{Na2S}=\frac{0,0175-0,0025}{0,1}=0,15M\\CM_{NaHS}=\frac{0,005}{0,1}=0,05M\end{matrix}\right.\)Câu 3:
Ta có:
\(\left\{{}\begin{matrix}n_{Zn}=\frac{13}{65}=0,2\left(mol\right)\\n_S=\frac{4}{32}=0,125\left(mol\right)\end{matrix}\right.\)
\(PTHH:Zn+S\rightarrow ZnS\)
Tỉ lệ : \(\frac{0,2}{1}>\frac{0,125}{1}\Rightarrow\) Zn dư
\(n_{ZnS}=0,125\left(mol\right)\)
\(n_{Zn\left(Dư\right)}=0,2-0,125=0,075\left(mol\right)\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\left\{{}\begin{matrix}n_{H2S}=n_{ZnS}=0,125\left(mol\right)\\n_{H2}=n_{Zn}=0,075\left(mol\right)\end{matrix}\right.\)
\(M_{hh}=\frac{0,125.34+0,075.2}{0,2}=22\)
\(D_{hh/H2}=\frac{22}{2}=11\)

a, PT: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Chất rắn A gồm Fe dư và FeS.
Theo PT: \(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Fe\left(dư\right)}=0,2\left(mol\right)\\n_{H_2S}=n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, %V cũng là % số mol.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,2+0,1}.100\%\approx66,67\%\\\%V_{H_2S}\approx33,33\%\end{matrix}\right.\)
b, Ta có: \(\Sigma n_{HCl\left(dadung\right)}=2n_{Fe}+2n_{FeS}=0,6\left(mol\right)\) (1)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{NaOH}=0,2\left(mol\right)\) (2)
Từ (1) và (2) \(\Rightarrow\Sigma n_{HCl}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\)
Bạn tham khảo nhé!

a. ptpư:
Fe + S → FeS
0,2 <----- 0,2 <------ 0,2
FeS + 2HCl → FeCl2 + H2S
0,2 <-------------------------- 0,2
Fe + 2HCl → FeCl2 + H2
0,1 <----------------------- 0,1
H2S + 2NaOH → Na2S + 2H2O
b.
nH2 = 2,24/22,4 = 0,1 mol
nH2S = 6,72/22,4 – 0,1 = 0,2 mol
nFe = 0,3 mol; nS =0,2
mX = (0,2+0,1).56 + 0,2.32 = 23,3 gam

Khi hòa tan Y vào dd HCl dư thu được chất rắn
=> Chất rắn là lưu huỳnh
mS(dư) = 1,2 (g)
\(n_{CuS}=\dfrac{14,4}{96}=0,15\left(mol\right)\) => nS(Z) = 0,15 (mol)
Bảo toàn S: mS(X) = 1,2 + 0,15.32 = 6 (g)

\(n_{hhkhí}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{ZnS}=b\left(mol\right)\end{matrix}\right.\)
Bảo toàn khối lượng: \(m_A=m_Y=35,6\left(g\right)\)
PTHH:
Zn + 2HCl ---> ZnCl2 + H2
a -------------------------> a
ZnS + 2HCl ---> ZnCl2 + H2S
b ------------------------------> b
Hệ pt \(\left\{{}\begin{matrix}65a+97b=35,6\\a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: Zn + S --to--> ZnS
0,3 <- 0,3 <----- 0,3
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=\left(0,1+0,3\right).65=26\left(g\right)\\m_S=0,3.32=9,6\left(g\right)\end{matrix}\right.\)

\(Fe+S\underrightarrow{t^o}FeS\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Do khí sau pư gồm H2, H2S => X chứa FeS, Fe

a) \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
=> \(n_{H_2S}=0,1\left(mol\right)\)
\(\%V_{H_2S}=\dfrac{0,1.22,4}{2,464}.100\%=90,9\%\)
\(\%V_{H_2}=100\%-90,9\%=9,1\%\)
b) \(n_{H_2}=\dfrac{2,464.9,1\%}{22,4}=0,01\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,01<-------------------0,01
FeS + 2HCl --> FeCl2 + H2S
0,1<---------------------0,1
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,01.56}{0,01.56+0,1.88}.100\%=5,983\%\\\%m_{FeS}=\dfrac{0,1.88}{0,01.56+0,1.88}.100\%=94,017\%\end{matrix}\right.\)