
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

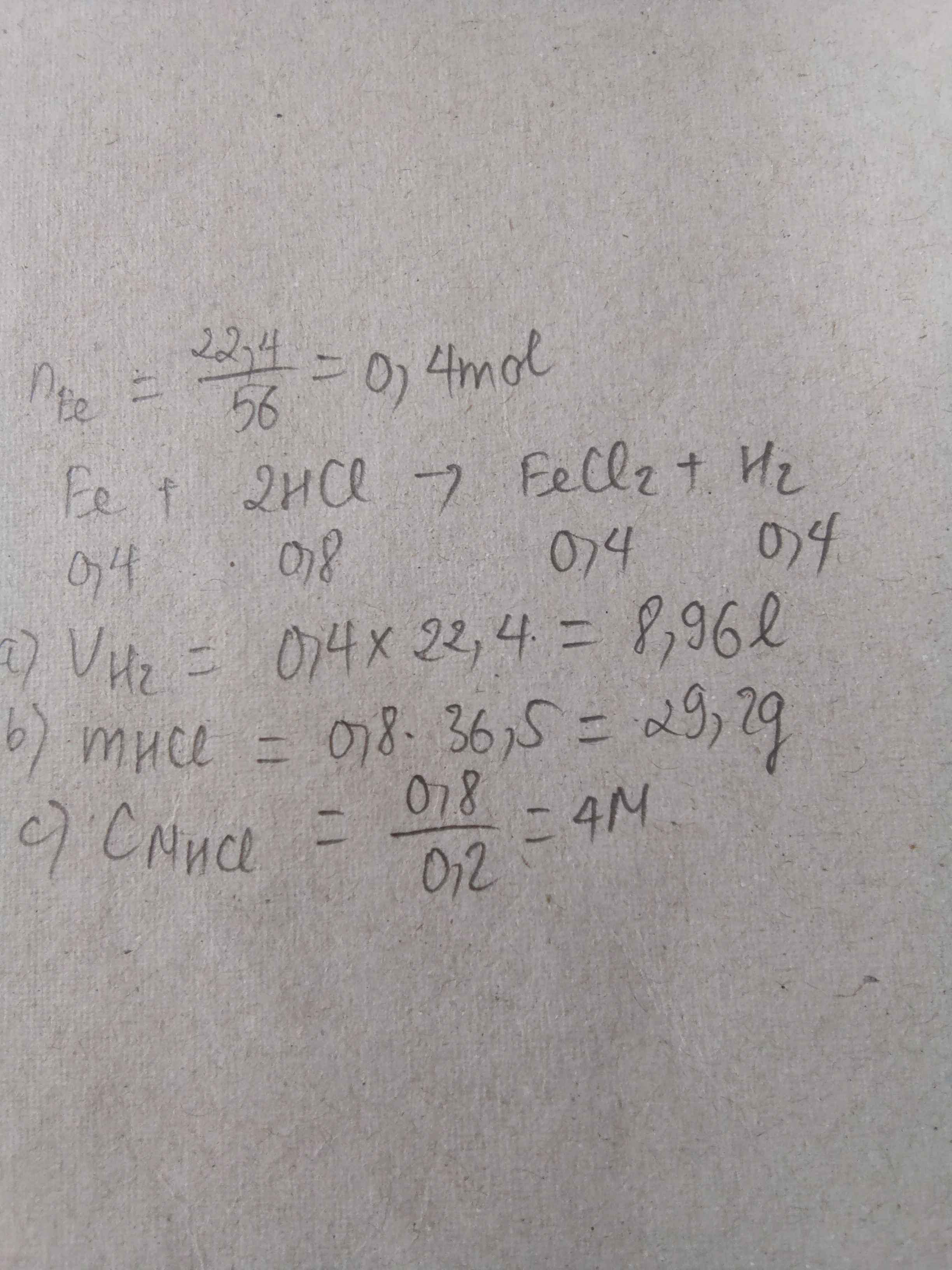

\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2......0.4........0.2.............0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{FeCl_2}=0.2\cdot127=25.4\left(g\right)\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
Câu c và câu d không liên quan tới dữ liệu đề bài cho !

Câu 1:
PTHH: 2Al + 3H2SO4 ===> Al2(SO4)3 + 3H2
a)Vì Cu không phản ứng với H2SO4 loãng nên 6,72 lít khí là sản phẩm của Al tác dụng với H2SO4
=> nH2 = 6,72 / 22,4 = 0,2 (mol)
=> nAl = 0,2 (mol)
=> mAl = 0,2 x 27 = 5,4 gam
=> mCu = 10 - 5,4 = 4,6 gam
b) nH2SO4 = nH2 = 0,3 mol
=> mH2SO4 = 0,3 x 98 = 29,4 gam
=> Khối lượng dung dịch H2SO4 20% cần dùng là:
mdung dịch H2SO4 20% = \(\frac{29,4.100}{20}=147\left(gam\right)\)
nH2 = 6.72 : 22.4 = 0.3 mol
Cu không tác dụng với H2SO4
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
0.2 <- 0.3 <- 0.1 <- 0.3 ( mol )
mAl = 0.2 x 56 = 5.4 (g)
mCu = 10 - 5.4 = 4.6 (g )
mH2SO4 = 0.3 x 98 = 29.4 ( g)
mH2SO4 20% = ( 29.4 x100 ) : 20 = 147 (g)

a, \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3KOH\rightarrow3KCl+Fe\left(OH\right)_{3\downarrow}\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}=6n_{Fe_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\)
b, \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=2n_{Fe_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe\left(OH\right)_3}=0,2.107=21,4\left(g\right)\)
\(n_{KOH}=3n_{FeCl_3}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{KOH}}=\dfrac{0,6}{0,2}=3\left(M\right)\)

200ml = 0,2l
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,3 0,6 0,3 0,3
a) \(n_{ZnCl2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(C_{M_{ZnCl2}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\)
b) \(n_{H2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) Pt : \(NaOH+HCl\rightarrow NaCl+H_2O|\)
1 1 1 1
0,6 0,6
\(n_{NaOH}=\dfrac{0,6.1}{1}=0,6\left(mol\right)\)
\(m_{NaOH}=0,6.40=24\left(g\right)\)
\(m_{ddNaOH}=\dfrac{24.100}{20}=120\left(g\right)\)
Chúc bạn học tốt

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6 0,2 0,3
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(C_{M\left(HCl\right)}=\dfrac{0,6}{0,6}=1\left(M\right)\)
\(m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)

a, PT: \(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b, Ta có: \(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{MgCO_3}=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCO_3}=0,1.84=8,4\left(g\right)\)
\(\Rightarrow m_{MgO}=10,4-m_{MgCO_3}=2\left(g\right)\)