Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khí Cl 2 khí clo ẩm có tính tẩy màu.
4HCl + MnO 2 → Mn Cl 2 + Cl 2 + 2 H 2 O

a)\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
0,15 0,15 0,15 0,15
b)Chất khử: \(Mg\)
Chất oxi hóa: \(H_2SO_4\)
Quá trình cho nhận e:
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(H_2^++2e\rightarrow H_2^0\)
c)Cách 1: \(m=0,15\cdot24=3,6g\)
Cách 2:
\(m_{H_2}=0,15\cdot2=0,3g\)
\(m_{H_2SO_4}=0,15\cdot98=14,7g\)
\(m_{MgSO_4}=0,15\cdot120=18g\)
BTKL: \(m_{Mg}+m_{H_2SO_4}=m_{MgSO_4}+m_{H_2}\)
\(\Rightarrow m_{Mg}+14,7=18+0,3\)
\(\Rightarrow m_{Mg}=3,6g\)

Khí SO 2 khí này làm mất màu dung dịch KMn O 4
2 H 2 SO 4 + Cu → CuS O 4 + SO 2 + 2 H 2
2 H 2 O + 2KMn O 4 + 5 SO 2 → 2 H 2 SO 4 + 2MnS O 4 + K 2 SO 4
(không màu) (tím) (không màu, mùi sốc) (không màu) (trắng)

\(4H\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}\mathop {Mn}\limits^{ + 4} {O_2} \to {\mathop {Cl}\limits^0 _2} + {\text{ }}\mathop {Mn}\limits^{ + 2} C{l_2} + {\text{ }}2{H_2}O\)
a)
\(\mathop {Mn}\limits^{ + 4} + 2e \to \mathop {Mn}\limits^{ + 2} \) => MnO2 là chất oxi hóa
\(\mathop {2Cl}\limits^{ - 1} \to \mathop {C{l_2}}\limits^0 + 2e\) => HCl là chất khử
b) HI có tính khử mạnh hơn HCl
=> HI có thể phản ứng được với MnO2
4HI + MnO2 → I2 + MnI2 + 2H2O

a) KClO3 + 6HCl --> KCl + 3Cl2 + 3H2O
Chất khử: HCl, chất oxh: KClO3
| QT khử | Cl+5 + 6e --> Cl-1 | x1 |
| QT oxh | 2Cl-1 - 2e --> Cl20 | x3 |
b) 2KMnO4 --to--> K2MnO4 + MnO2 + O2
Chất khử: KMnO4, chất oxh: KMnO4
| QT khử | 2Mn+7 + 4e --> Mn+6 + Mn+4 | x1 |
| QT oxh | 2O-2 - 4e --> O20 | x1 |
\(a.QToxh:2\overset{-1}{Cl}\rightarrow Cl_2+2e|\times5\\QTkhử:2\overset{+5}{Cl}+10e\rightarrow \overset{0}{Cl_2}|\times1\)
HCl là chất oxi hóa, KClO3 là chất khử
\(KClO_3+6HCl_{đặc}\rightarrow KCl+3Cl_2+3H_2O\)
\(b.QToxh:2\overset{-2}{O}\rightarrow\overset{0}{O_2}+4e|\times1\\ QTkhử:2\overset{+7}{Mn}+4e\rightarrow\overset{+6}{Mn}+\overset{+4}{Mn}|\times1\)
KMnO4 vừa là chất khử, vừa là chất oxi hóa
\(2KMnO_4-^{t^o}\rightarrow K_2MnO_4+MnO_2+O_2\)

Khí H 2 cháy trong không khí kèm theo tiếng nổ nhỏ.
H 2 SO 4 + Zn → Zn SO 4 + H 2
H 2 + 1/2 O 2 → H 2 O

a) Giả sử lấy lượng mỗi chất là a gam
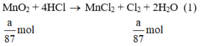
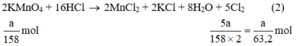
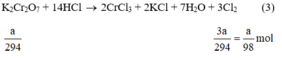
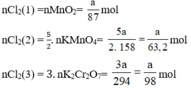
Ta có: 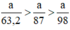
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 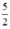 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

\(n_{SO_2}=\dfrac{2,8}{22,4}=0,125mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,125 0,125 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,25 0,125 ( mol )
\(m_{KMnO_4}=0,25.158=39,5g\)
a, 2KMnO4+16HCl→2KCl +2MnCl2+5Cl2+8H2O Chất khử là HCl , Chất oxi hóa là KMnO4 Quá trình oxi hóa : 2Cl−→Cl2+2e Quá trình khử : Mn+7+5e→Mn+2MnO2+4HCl→MnCl2+Cl2+2H2O Quá trình oxi hóa : 2Cl−→Cl2+2e Quá trình khử : Mn+4+2e→Mn+22KMnO4+16HCl→2KCl+2MnCl2+5Cl2+8H2O Chất khử là HCl , Chất oxi hóa là KMnO4 Quá trình oxi hóa : 2Cl−→Cl2+2e Quá trình khử : Mn+7+5e→Mn+2MnO2+4HCl→MnCl2+Cl2+2H2O Quá trình oxi hóa : 2Cl−→Cl2+2e Quá trình khử : Mn+4+2e→Mn+2
Chất khử là HClHCl , chất oxi hóa là MnO2