Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
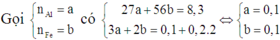
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO
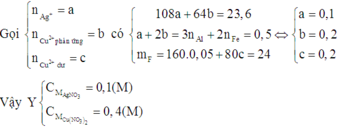

Đáp án là D.
Dung dịch chứa 2 ion kim loại đó là Fe2+ và Cu2+.

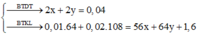



Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
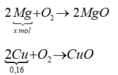
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C

Đáp án C
Ta có:
n A g = 0 , 5 m o l → n C u = 0 , 25 m o l
→ m C u = 16 g a m → a = 15 , 5 g a m

Đáp án D
Trong phản ứng của Fe với dung dịch X, chất khử là Fe, chất oxi hóa là NO 3 - / H + , Fe3+ và Cu2+. Sau phản ứng thu được hỗn hợp kim loại, chứng tỏ Fe dư nên muối tạo thành trong dung dịch là Fe2+.
Áp dụng bảo toàn electron trong phản ứng của Fe với dung dịch X, bảo toàn điện tích trong dung dịch Y và bảo toàn nguyên tố Fe, N, ta có :
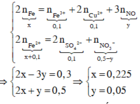
Theo bảo toàn khối lượng, ta có :

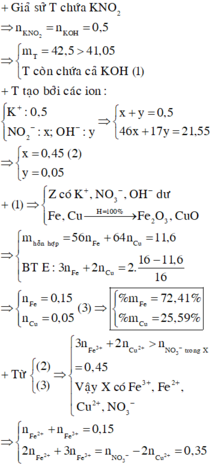
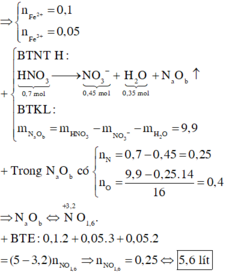
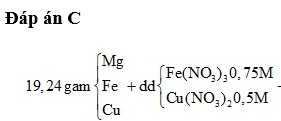


Câu 1 :
\(n_{FeCl_3} = \dfrac{28,275}{162,5}=0,174(mol)\\ \)
Fe + 2FeCl3 → 3FeCl2
0,087.......0,174.......0,261...............(mol)
Vậy :
m = 0,087.56 + 11,928 = 16,8(gam)
mmuối = 0,261.127 = 33,147(gam)
Câu 2:
\(n_{AgNO_3\ pư} = \dfrac{250.6,8\%}{170}-\dfrac{12,75}{170} = 0,025(mol)\\ \)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,0125....0,025........0,0125........0,025...........(mol)
Vậy :
Sau phản ứng :
mthanh Cu = mthanh Cu - mCu phản ứng + mAg
=20-0,0125.64+0,025.108=21,9(gam)