Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 0,8.1=0,8(mol)
CTHH: RxOy
PTHH: \(R_xO_y+2yHCl->xRCl_{\dfrac{2y}{x}}+yH_2O\)
_______\(\dfrac{0,4}{y}\)<----0,8____________________(mol)
=> \(M_{R_xO_y}=\dfrac{23,2}{\dfrac{0,4}{y}}=58y\left(g/mol\right)\)
=> x.MR = 42y => \(M_R=21.\dfrac{2y}{x}\)
Xét \(\dfrac{2y}{x}=1\) => MR = 21 (L)
Xét \(\dfrac{2y}{x}=2\) => MR = 42 (L)
Xét \(\dfrac{2y}{x}=3=>M_R=63\left(L\right)\)
Xét \(\dfrac{2y}{x}=\dfrac{8}{3}=>M_R=56\left(Fe\right)\)

Bài 6:
\(R_2O+H_2O\rightarrow2ROH\\ n_{ROH}=0,2\left(mol\right)\rightarrow n_{R_2O}=0,1\left(mol\right)\\ \rightarrow M_{R_2O}=\dfrac{6,2}{0,1}=62\left(\dfrac{g}{mol}\right)\\Lại.có:M_{R_2O}=2M_R+16\\ \Rightarrow2M_R+16=62\\ \Leftrightarrow M_R=23\left(\dfrac{g}{mol}\right)\\ \Rightarrow R\left(I\right):Natri\left(Na=23\right)\)
Bài 7:
\(n_{H_2}=0,4\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \rightarrow\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{11}.100\approx49,091\%\\\%m_{Fe}\approx50,909\%\end{matrix}\right.\)

Đặt: \(n_M=a\left(mol\right);n_{M_2O}=b\left(mol\right)\)
Từ công thức Oxit cho thấy khả năng cao M là kim loại hoá trị I (Phòng trường hợp các kim loại đa hoá trị, điển hình là Cu có hoá trị I,II)
\(PTHH:\\ M+HCl\rightarrow MCl+\dfrac{1}{2}H_2\left(1\right)\\ M_2O+2HCl\rightarrow2MCl+H_2O\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow a+2b=0,2\left(mol\right)\Rightarrow b< 0,1\)
Theo đề bài ta có phương trình:
\(M.a+\left(2M+16\right)b=8,6\\ \Leftrightarrow0,2M+16b=8,6\\ \Leftrightarrow M+80b=43\left(2\right)\Rightarrow M< 43\)
\(\left(2\right)\Rightarrow b=\dfrac{43-M}{80}< 0,1\Rightarrow M>35\)
Kết hợp 2 bất phương trình ta được: \(35< M< 43\Rightarrow M=39\left(K\right)\)
Vậy kim loại M là Kali (Kí hiệu: K). Công thức oxit: K2O
Đây là cách làm chỉ mang tính chất tham khảo! Nếu có sai sót thì comment cho mình biết và sửa chữa, rút kinh nghiệm
P/s: Mình có làm tắt vài chỗ, nếu thấy chỗ nào khó hiểu vui lòng comment để mình giải đáp sớm nhất. Thấy hay thì cho mình xin 1 like để ủng hộ nha!


Chào bạn tuy không thể giúp bạn nhưng cho mình hỏi bạn có bị mất thanh thông báo tin nhắn như mình không ạ

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
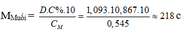
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
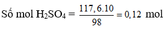
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

1) Gọi công thức của oxit là AO. Số mol HCl là 0,4.1=0,4 (mol).
AO (0,2 mol) + 2HCl (0,4 mol) \(\rightarrow\) ACl2 + H2\(\uparrow\).
Phân tử khối của oxit là 8,0/0,2=40 (g/mol).
Vậy A là magie (Mg) và công thức hóa học của oxit là MgO.
2) Số mol MgCO3 và H2SO4 lần lượt là 8,4/84=0,1 (mol) và 0,5.1=0,5 (mol).
Các chất tan trong dung dịch sau phản ứng gồm MgSO4 (0,1 mol) và H2SO4 dư (0,4 mol) có nồng độ mol lần lượt là 0,1/0,5=0,2 (M) và 0,4/0,5=0,8 (M).
\(1,n_{HCl}=0,4.1=0,4\left(mol\right)\\ PTHH:AO+2HCl\rightarrow ACl_2+H_2O\\ Mol:0,2\leftarrow0,4\\ M_{AO}=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A+16=40\\ \Leftrightarrow A=24\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A.là.Mg\\ CTHH:MgO\)
\(2,n_{H_2SO_4}=1.0,5=0,5\left(mol\right)\\ PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+CO_2\uparrow+H_2O\\ Mol:0,5\leftarrow0,5\rightarrow0,5\\ C_{M\left(MgSO_4\right)}=\dfrac{0,5}{0,5}=1M\)

Sửa đề: Cho 8.64 g hỗn hợp gồm Fe2O3 và 1 oxit kim loại hóa trị II số mol = nhau tác dụng vừa đủ với 320 ml dd HCl 1M . Xác định oxit chưa biết ?
Giải:
Gọi oxit cần tìm là XO
PTHH: Fe2O3 + 6HCl --> 2FeCl3 + 3H2O (1)
(mol)..........x............6x
XO + 2HCl --> XCl2 + H2O (2)
(mol).......x..............2x
Ta có: nHCl (1)+(2) = 0,32.1 = 0,32 mol
=> 6x + 2x = 0,32 mol
=> 8x = 0,32 mol
=> x = 0,04 mol
=> \(m_{Fe_2O_3}=0,04.160=6,4g\)
=> \(m_{XO}=8,64-6,4=2,24g\)
=> \(M_{XO}=\dfrac{2,24}{0,04}=56\) ( mol/g)
=> \(X=56-16=40\) ( Ca)
Vậy oxit cần tìm là CaO
Đề này sai thì phải