Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đáp án C
- Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
⇒ X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6

Đáp án C
Vì đốt cháy A thu được CO2 và H2O nên A chứa C, H, có thể có O.
Khi đó gọi công thức phân tử của A là CxHyOz
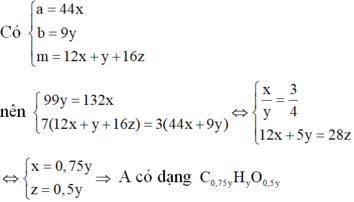
![]()
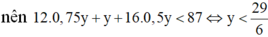
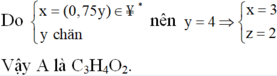
Nhận xét: Khi làm đến bước x : y = 3 :4 và kết hợp với quan sát 4 đáp án, ta có thể kết luận ngay A là C3H4O2.

MX = 30.2 = 60(g/mol)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Bảo toàn C: nC = 0,2 (mol)
Bảo toàn H: nH = 0,4 (mol)
=> \(n_O=\dfrac{6-0,2.12-0,4.1}{16}=0,2\left(mol\right)\)
Xét nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2: 1
=> CTPT: (CH2O)n
Mà MX = 60(g/mol)
=> n = 2
=> CTPT: C2H4O2
=> C
\(M_X=30.2=60\left(\dfrac{g}{mol}\right)\)
Ta có: \(m_{O_{\left(CO_2\right)}}=\dfrac{8,8}{44}.16.2=6,4\left(g\right)\)
\(m_{O_{\left(H_2O\right)}}=\dfrac{3,6}{18}.16=3,2\left(g\right)\)
\(\Rightarrow m_{O_{\left(thu\right)}}=6,4+3,2=9,6\left(g\right)\)
Ta lại có: \(m_{O_2}=8,8+3,6-6=6,4\left(g\right)\)
Ta thấy: \(6,4< 9,6\)
Vậy trong X có: C, H, O
Gọi CTHH của X là: \(\left(C_xH_yO_z\right)_n\)
Ta có: \(m_{C_{\left(X\right)}}=m_{C_{\left(CO_2\right)}}=\dfrac{8,8}{44}.12=2,4\left(g\right)\)
\(m_{H_{\left(X\right)}}=m_{H_{\left(H_2O\right)}}=\dfrac{3,6}{18}.1.2=0,4\left(g\right)\)
\(m_{O_{\left(X\right)}}=9,6-6,4=3,2\left(g\right)\)
\(\Rightarrow x:y:z=\dfrac{2,4}{12}:\dfrac{0.4}{1}:\dfrac{3,2}{16}=0,2:0,4:0,2=2:4:2\)
Vậy CTHH của X là: \(\left(C_2H_4O_2\right)_n\)
Mà: \(M_X=\left(12.2+1.4+16.2\right).n=60\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow n=1\)
Vậy CTHH của X là: C2H4O2
Chọn C

![]()
Vì Y chỉ chứa C và H nên sản phẩm cháy thu được gồm CO2 và H2O.
Bảo toàn nguyên tố oxi 2 vế, ta có:
![]()
Có
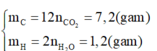
Gọi công thức phân tử của chất Y là CxHy

Do đó công thức phân tử của Y có dạng .![]()
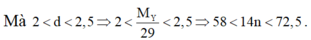
Mà n là số nguyên nên n = 5
Vậy chất hữu cơ Y là C5H10.
Đáp án B.

\(n_{CO_2}=\dfrac{4.4}{44}=0.1\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(n_O=\dfrac{2.2-0.1\cdot12-0.1\cdot2}{16}=0.05\left(mol\right)\)
\(n_C:n_H:n_O=0.1:0.2:0.05=2:4:1\)
CT đơn giản nhất : C2H4O
\(M_A=22\cdot2=44\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow44n=44\)
\(\Rightarrow n=1\)
\(CT:C_2H_4O\)

Theo đề bài ta có 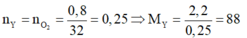
Vì sản phẩm cháy thu được CO2 và H2O nên Y chắc chắn chứa C, H, có thể có O.
Khối lượng các nguyên tố trong 4,4 gam chất Y là:
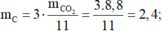
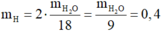
![]()
Gọi CTPT của chất Y là CxHyOz . ta có như sau:
Vậy ta có x = 4, y = 8 và z = 2
CTPT của Y là C4H8O2
Đáp án A.

\(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Bảo toàn C; nC = 0,3 (mol)
Bảo toàn H: nH = 0,6 (mol)
Bảo toàn O: \(n_O=0,3.2+0,3-0,3.2=0,3\left(mol\right)\)
Xét nC : nH : nO = 0,3 : 0,6 : 0,3 = 1 : 2 : 1
=> CTPT: (CH2O)n
Mà MA = 7,5.4 = 30 (g/mol)
=> n = 1
=> CTPT: CH2O
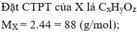
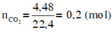
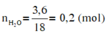

Đáp án B