Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
M + 2HCl → MCl2 + H2
M (M+71)
8,45g 17,68g
=> 17,68.M = 8,45.(M+71)
=> M = 65 (Zn)

\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(2A+2nH_2O\rightarrow2A\left(OH\right)_n+nH_2\)
\(\dfrac{0.1}{n}........................0.05\)
\(M_A=\dfrac{3.9}{\dfrac{0.1}{n}}=39n\)
Với : \(n=1\rightarrow A=39\)
\(A:K\)
\(m_{KOH}=0.1\cdot56=5.6\left(g\right)\)
\(m_{ddX}=3.9+46.2-0.05\cdot2=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{5.6}{50}\cdot100\%=11.2\%\)
\(b.\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.1....................0.2\)
\(m_{KOH}=0.2\cdot56=11.2\left(g\right)\)
\(m_{dd_X}=\dfrac{11.2}{28\%\%}=40\left(g\right)\)

MgO+ 2HCl -----> MgCl2 + H2O (1)
CuO + 2HCl ------> CuCl2 + H2O (2)
Đặt x_ n MgO ; y_ n CuO
Theo đề bài ta có hệ: \(\left\{{}\begin{matrix}40x+80y=16\\2x+2y=0,25.2,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
Theo PT(1) : n MgCl2=nMg =0,2 (mol)
Theo PT(2) : n CuCl2 = nCuO =0,1(mol)
=> m A= 0,2.95 + 0,1.135=20,6(g)

Gọi kim loại cần tìm là R
\(n_{H_2SO_4}=0,25.0,3=0,075\left(mol\right)\)
\(n_{KOH}=0,06.0,5=0,03\left(mol\right)\)
PTHH: R + H2SO4 --> RSO4 + H2
0,06<--0,06
2KOH + H2SO4 --> K2SO4 + 2H2O
0,03-->0,015
=> \(M_R=\dfrac{1,44}{0,06}=24\left(g/mol\right)\)
=> R là Mg
Số mol H2SO4 và KOH lần lượt là 0,3.0,25=0,075 (mol) và 0,5.0,06=0,03 (mol).
Số mol H2SO4 phản ứng là (0,075.2-0,03):2=0,06 (mol) và bằng số mol của kim loại ban đầu.
Nguyên tử khối của kim loại cần tìm là 1,44:0,06=24 (g/mol).
Vậy kim loại đã cho là magie (Mg).

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10
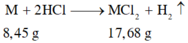
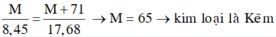

Câu 10:
\(MgO+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x_______
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
y_______2y______y________
Giải hệ PT
\(\left\{{}\begin{matrix}40x+81y=16,1\\95x+136y=32,6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow n_{HCl}=0,4+0,2=0,6\left(mol\right)\)
\(\Rightarrow a=\frac{0,6}{0,25}=2,4M\)
Câu 34:
Công thức của oxit có dạng MO
\(n_{HCl}=0,6\left(mol\right)\)
\(PTHH:MO+2HCl\rightarrow MCl_2+H_2O\)
______0,3 _______0,6_____________
\(n_{MO}=0,3\left(mol\right)\)
\(M=\frac{12}{0,3}=40\)
Ta có:
40=M của M+M O
40=M của M+16
\(\Rightarrow M_M=24\left(Mg\right)\)
Vậy kim loại M là Mg
Câu 3:
Ta có:
\(n_{HCl}=0,86\left(mol\right)\)
\(R_xO_y+2yHCl\rightarrow xRCl_{\frac{2y}{x}}+yH_2O\)
\(\Rightarrow n_{RxOy}=\frac{0,86}{2y}\left(mol\right)\)
\(\Leftrightarrow m_{RxOy}=34y\)
Lập bảng biện luận tìm được R là Al