Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,2->0,2---->0,2
Pư trên thuộc loại pư hóa hợp do từ 2 chất là S, O2 ban đầu tạo ra 1 chất là SO2
VO2 = 0,2.22,4 = 4,48 (l)

Bài 3 :
- PTHH : \(S+O_2\left(t^o\right)->SO_2\) (1)
- PƯ trên thuộc loại PƯ cháy vì ta phải đốt lưu huỳnh nên có sự cháy giữa lưu huỳnh và oxi
- Ta có : \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
Từ (1) -> \(n_{O_2}=n_S=0,2\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Bài 4 :
- PTHH : \(3Fe+2O_2\left(t^o\right)->Fe_3O_4\) (2)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{42}{56}=0,75\left(mol\right)\)
Từ (2) -> \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,5\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=n.22,4=0,5.22,4=11,2\left(l\right)\)
Từ (2) -> \(n_{Fe_2O_3}=\dfrac{1}{3}n_{Fe}=0,25\left(mol\right)\)
=> \(m_{Fe_2O_3}=n.M=0,25.\left(56.2+16.3\right)=40\left(g\right)\)

a) $S + O_2 \xrightarrow{t^o} SO_2$
b)
Theo PTHH :
$n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)$
$m_{O_2} = 0,1.32 = 3,2(gam)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
Ta có: n S = 3,2 / 32 = 0,1 ( mol )
PTHH: S + O2 \(\rightarrow\) SO2
0,1--0,1-----0,1
Theo pthh
n O2 = 0,1 ( mol ) => m O2 = 3,2 ( g )
n SO2 = 0,1 ( mol ) => V SO2 = 2,24 ( lít )

\(n_{SO_2}=\dfrac{V_{SO_2\left(ĐKTC\right)}}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
...........1.........1........1......
...........0,3......0,3......0,3.....
a. \(m_S=n_S\cdot M_S=0,3\cdot32=9,6\left(g\right)\)
b. \(V_{O_2\left(ĐKTC\right)}=n_{O_2}\cdot22,4=0,3\cdot22,4=6,72\left(l\right)\)
\(V_{kk\left(ĐKTC\right)}=V_{O_2\left(ĐKTC\right)}\cdot5=6,72\cdot5=33,6\left(l\right)\)

2.
a) 2Na + O2 -> 2NaO
b) P2O5 + 3H2O -> 2H3PO4
c) HgO -> Hg + 1/2O2
d) 2Fe(OH)3 -> Fe2O3 + 3H2O
e) Na2CO3 + CaCl2 -> CaCO3 + 2NaCl

a) Phương trình hóa học S + O2 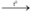 SO2
SO2
b) nS = 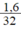 = 0,05 mol.
= 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm 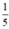 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l

S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l
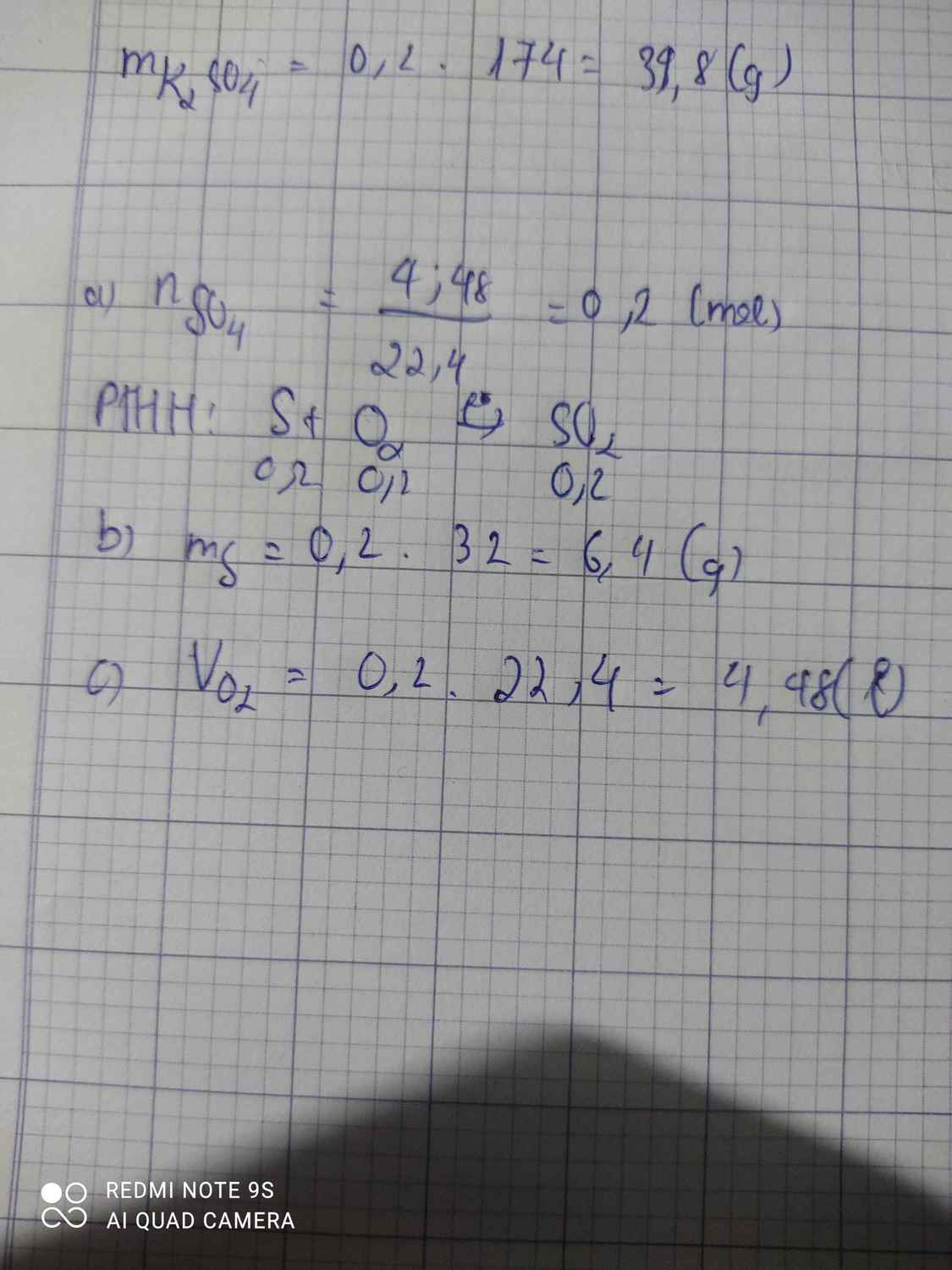
1/
* Làm gỉ các kim loại khi để kim loại lâu trong khí oxi:
-Kim loại mạnh tác dụng với oxi ở nhiệt độ thường. Do đó các kim loại này thường ở dạng hợp chất ngoài không khí.
-Kim loại trung bình và đồng phản ứng với oxi ở nhiệt độ cao. Một số kim loại để lâu ngoài không khí tạo thành hợp chất oxitlàm mất dần đi tính chất ban đầu, ví dụ như để sắt ngoài không khí ẩm lâu ngày tạo thành Fe2O3 (Sắt (III) oxit) rất giòn và dễ gãy, người ta gọi hiện tượng này là gỉ sét.
-Kim loại yếu còn lại khó tham gia phản ứng với oxi (như vàng, bạc, platin).
PTPƯ minh họa:
Na+O2\(\rightarrow\)NaO2
4Al+3O2\(\rightarrow\)2Al2O3
Công thức chung:
Kim loại + oxi \(\rightarrow\) oxit kim loại
* Có thể tác dụng với phi kim(trừ các loại halogen)
PTPƯ minh họa:
C+O2\(\rightarrow\)CO2
Công thức chung
Phi kim + khí oxi → oxit phi kim