Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
Ta có: \(n_{KOH}=0,2\cdot0,5=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4}=n_{K_2SO_4}=0,05\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{H_2SO_4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,05}{0,2+0,1}\approx0,17\left(M\right)\end{matrix}\right.\)
Bài 1 :
200ml = 0,2l
100ml = 0,1l
\(n_{KOH}=0,5.0,2=0,1\left(mol\right)\)
a) Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O|\)
2 1 1 2
0,1 0,05 0,05
b) \(n_{H2SO4}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(C_{M_{ddH2SO4}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\)
c) \(n_{K2SO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(V_{ddspu}=0,2+0,1=0,3\left(l\right)\)
\(C_{M_{K2SO4}}=\dfrac{0,05}{0,3}=\dfrac{1}{6}\left(M\right)\)
Chúc bạn học tốt

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

\(a.n_{CO_2}=\dfrac{0,672}{22,4}=0,03mol\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(n_{CO_2}=n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,03mol\\ m_{CaCO_3}=0,03.100=3g\\ b.V_{ddCa\left(OH\right)_2}=\dfrac{0,03}{1,5}=0,02l\)

Đổi 500 ml= 0,5l
Ta có: \(n_{Na2CO3}=\frac{26,5}{106}=0,25\left(mol\right)\)
\(n_{KOH}=0,5.1=0,5\left(mol\right)\)
Vì nNa2CO3 < nKOH nên nKOH dư
a) \(PTHH:Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\)
Sau phản ứng thu được muối Na2SO4
Ta có:
\(n_{Na2SO4}=n_{Na2CO3}=0,5\left(mol\right)\) (vì tỉ lệ 1:1)
b, \(m_{Na2SO4}=0,5.142=71\left(g\right)\)
Bạn xem lại đề ý b nha

a) 2Fe + 3Cl2 --> 2FeCl3
b) \(n_{Fe}=\dfrac{5,6}{56}=0.1\left(mol\right)\)
2Fe + 3Cl2 --> 2FeCl3
0,1------------------->0,1
=> mFeCl3 = 0,1.162,5=16,25(g)
c) \(C_M=\dfrac{0,1}{0,1}=1M\)

a/ \(n_{KOH}=0,2.1=0,2\left(mol\right);n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + 2H2O
Mol: 0,2 0,1 0,1
Ta có: \(\dfrac{0,2}{2}< \dfrac{0,3}{1}\) ⇒ KOH hết, H2SO4 dư
b/ \(m_{H_2SO_4dư}=\left(0,3-0,1\right).98=19,6\left(g\right)\)
c/ Vdd sau pứ = 0,2 + 0,3 = 0,5 (l)
d/ \(C_{M_{ddK_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
\(C_{M_{ddH_2SO_4dư}}=\dfrac{0,3-0,1}{0,5}=0,4M\)

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 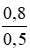
CM (NaOH)dư = 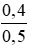
tích cho mình nha![]()
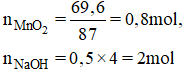
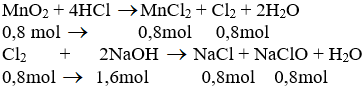
1a) \(n_{CO_2}=0,14\left(mol\right);n_{Ca\left(OH\right)_2}=0,08\left(mol\right)\Rightarrow n_{OH^-}=0,16\left(mol\right)\)
\(\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,16}{0,14}=1,14\) => Tạo 2 muối
\(Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
b) Gọi x, y là số mol Ca(HCO3)2 và CaCO3
\(\left\{{}\begin{matrix}x+y=0,08\\2x+y=0,14\end{matrix}\right.\)
=> x=0,06 ; y=0,02
\(m_{CaCO_3}=0,02.100=2\left(g\right)\)
c) \(CM_{Ca\left(HCO_3\right)_2}=\dfrac{0,06}{0,8}=0,075M\)
2. a) Bảo toàn nguyên tố C : \(n_{CO_2}=n_{Na_2CO_3}=0,25\left(mol\right)\)
\(n_{KOH}=0,5\left(mol\right)\)
Lập T = \(\dfrac{n_{KOH}}{n_{CO_2}}=\dfrac{0,5}{0,25}=2\) => Tạo 1 muối K2CO3, các chất phản ứng hết
b) \(m_{K_2CO_3}=0,25.138=34,5\left(g\right)\)