


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




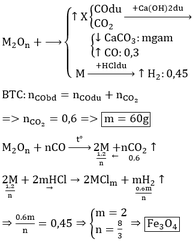
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

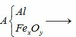
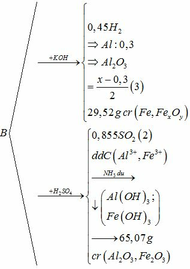
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
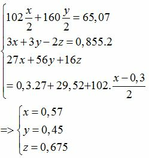
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
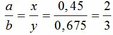
=> Fe2O3

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

a)
+nH2 = 0.896/22.4 = 0.04 (mol)
CuO + CO(t*) => Cu + CO2↑
0.01....0.01..........0.01..0.01
FexOy + yCO(t*) => xFe + yCO2↑
0.04/x........................0.04
_Chất rắn sau phản ứng là Fe và Cu => m(rắn) = mCu + mFe = 2.88
_Cu không phản ứng với dd HCl loãng:
Fe + 2HCl => FeCl2 + H2↑
0.04..0.08.......0.04.......0.04
=>mFe = 0.04*56 = 2.24(g)
=>mCu = 2.88 - 2.24 = 0.64 (g)
=>nCu = nCuO = 0.64/64 = 0.01 (mol)
=>mCuO = 0.01*80 = 0.8 (g)
=>mFexOy = 4 - 0.8 = 3.2(g)
b)
+mFe = 2.24 (g)
=>mO = 3.2 - 2.24 = 0.96 (g)
=>nFe = 2.24/56 = 0.04 (mol)
=>nO = 0.96/16 = 0.06 (mol)
=>nFe : nO = 0.04 : 0.06 = 2 : 3
Vậy công thức oxit sắt là Fe2O3.

a) \(CuO+CO\underrightarrow{t^o}Cu+CO2\)
\(FexOy+yCO\underrightarrow{t^o}xFe+yCO2\)
\(Fe+2HCl\rightarrow FeCl2+H2\)
Ta có:
\(n_{H2}=\dfrac{4,704}{22,4}=0,21\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,21\left(mol\right)\Rightarrow m_{Fe}=11,76\left(g\right)\)
\(\Rightarrow m_{Cu}=14,32-11,76=2,56\left(g\right)\)
\(\Rightarrow n_{Cu}=\dfrac{2,56}{64}=0,04\left(mol\right)\)
\(\Rightarrow n_{CuO}=0,04\left(mol\right)\)
\(\Rightarrow\%m_{CuO}=\dfrac{0,04.80}{19,44}.100\%=16,46\%\)
\(\Rightarrow\%m_{FexOy}=100-16,46=83,54\%\)
b) \(m_{FexOy}=19,44-0,04.80=16,24\left(g\right)\)
\(n_{Fe}=0,21\left(mol\right)\)
\(\Rightarrow n_{FexOy}=\dfrac{1}{x}n_{Fe}=\dfrac{0,21}{x}\left(mol\right)\)
\(M_{FexOy}=\dfrac{16,24}{\dfrac{0,21}{x}}=\dfrac{232}{3}x\)
| x | 1 | 2 | 3 |
| \(M_{FexOy}\) | 77,33(loại) | 154,6(loại) | 232(TM) |
\(\Rightarrow FexOy\) là \(Fe3O4\)
Chúc bạn học tốt ^^
Câu a tính khối lượng mỗi chất trong hh ban đầu phải không ạ?

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
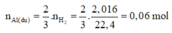
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
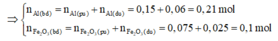
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.