Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải chi tiết:
Gọi công thức chung của kim loại kiềm đó là X
X + HCl → XCl + 0,5H2
Theo PTHH: nX = 2nH2 = 0,2 mol
=> Li (M = 7) < MX = 3,8 : 0,2 = 19 < Na (M = 23)
Đáp án A

\(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\\n_{Fe}=c\left(mol\right)\end{matrix}\right.\)⇒ 24a + 27b + 56c = 26,05(1)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al +6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\)
\(Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = a + 1,5b + 1,5c = \dfrac{17,36}{22,4} = 0,775(3)\)
Từ (1)(2)(3) suy ra: a = 0,325 ; b = -0,05 ; c = 0,35
→ Sai đề.

Gọi kl kiềm là A.
A + H2O -> AOH + 1/2 2
nH2= 0,1(mol) -> nA=0,2(mol)
=>M(A)=mA/nA=4,6/0,2=23(g/mol)
->A là Natri (Na=23)
PTHH: Na + H2O -> NaOH + 1/2 H2
0,2_____________0,2________0,1(mol)
mNaOH=0,2.40=8(g)
mddNaOH=mNa+ mH2O - mH2= 4,6+95,6-0,1.2=100(g)
-> C%ddNaOH= (8/100).100=8%

Coi hỗn hợp Y gồm :
Kim loại : 14,3(gam)
O :(x mol)
\(2H^+ + O^{2-}\to H_2O\\ 2H^+ + 2e \to H_2\)
Ta có : \(n_{Cl^-} = n_{HCl} = n_{H^+} = 2n_O + 2n_{H_2} = 2x + 0,4(mol)\)
Mà :
\(m_{muối} = m_{kim\ loại} + m_{Cl^-} = 14,3 + (2x + 0,4).35,5 = 49,8(gam)\\ \Rightarrow x = 0,3\)
Vậy : \(a = m_{kim\ loại} + m_O = 14,3 + 0,3.16 = 19,1(gam)\)




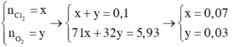
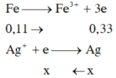
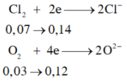
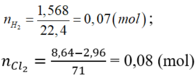
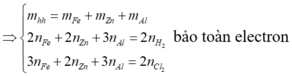
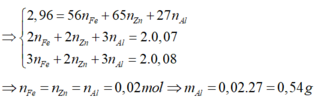
1. Cho 8,7 gam Manganđioxit tan trong axit HCl dư, đun nóng. Thể tích khí H2 (đktc) và khối lượng muối thu được là
A. 2,24 lít và 12,6 gam
B. 4,48 lít và 16,2 gam
C. 2,24 lít và 8,1 gam
D. 2,24 lít và 1,62 gam
Giải
Sơ đồ: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(\Rightarrow n_{MnO}=n_{Cl2}=n_{MnO2}=0,1\left(mol\right)\)
\(\Rightarrow V=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow m_{MnCl2}=12,6\left(g\right)\)
2.Trộn 2 khí với tỷ lệ thể tích 1:1 ngoài ánh sáng mặt trời thì có hiện tượng nổ. Hai khí đó là 2 khí nào trong số các khí sau?
A. N2 và H2 B. O2 và H2 C. Cl2 và H2 D. Cl2 và H2S
P/s : Phản ứng nổ của hỗn hợp Cl2, H2 1:1
3. Hòa tan 2,24 lít khí hiđroclorua (đktc) vào 46,35 gam nước thu được dung dịch axit clohiđric có nồng độ là
A. 73% B. 7,3% C. 2,15% D. 7,874%
Giải :
\(n_{HCl}=0,1\left(mol\right)\)
\(C\%_{HCl}=\frac{0,1.36,5}{0,1.36,5+46,35}.100\%=7,3\%\)
4. Khi cho 10,5 gam Natri iotua vào 50 ml dung dịch nước Brom 0,5M. Khối lượng Natri bromua thu được là
A. 3,45 gram
B. 4,67 gram
C. 5,15 gram
D. 8,75 gram
Giải :
\(n_{NaI}=0,07\left(mol\right)\)
\(n_{Br2}=0,025\left(mol\right)\)
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
\(\Rightarrow\) Dư NaI. Tạo 0,05 mol NaBr
\(\Rightarrow m_{NaBr}=5,15\left(g\right)\)
5. Đốt cháy hoàn toàn 11,2 gam kim loại R trong khí clo dư thu được 32,5 gam muối clorua. Nếu hòa tan hoàn toàn lượng kim loại R trên trong dung dịch HCl dư thì thể tích H2 thu được ở đktc là
A. 6,72 l B. 2,24 l C. 8,96 l D. 4,48 l
Giải :
\(m_{Cl2}=32,5-11,2=21,3\left(g\right)\)
\(\Rightarrow n_{Cl2}=0,3\left(mol\right)\)
\(2R+xCl_2\rightarrow2RCl_x\)
\(n_R=\frac{0,6}{x}\left(mol\right)\)
\(M_R=\frac{11,2x}{0,6}=\frac{56x}{3}\)
\(x=3\Rightarrow M_R=56\left(Fe\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow V=0,2.22,4=4,48\left(l\right)\)