Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

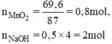
a) Phương trình hóa học của phản ứng:
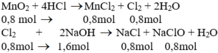
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 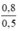 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 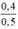 = 0,8 mol/ lit
= 0,8 mol/ lit

Câu 1 :
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
\(n_{CaCO3}=\dfrac{15}{100}=0,15\left(mol\right)\)
Pt : \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O|\)
1 2 1 1 1
0,15 0,2 0,1
Lập tỉ số so sánh : \(\dfrac{0,15}{1}>\dfrac{0,2}{2}\)
⇒ CaCO3 dư , Hcl phản ứng hết
⇒ Tính toán dựa vào số mol của Hcl
\(n_{CO2}=\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
\(V_{CO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
Chúc bạn học tốt

Đáp án B.
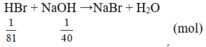
=>NaOH dư, HBr phản ứng hết => dung dịch làm quỳ chuyển sang màu xanh.

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
500 ml = 0,5l
\(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(n_{MnO_2}=\frac{69,6}{87}=0,8\left(mol\right)\)
a, \(MnO_2+4HCl->MnCl_2+Cl_2+2H_2O\) (1)
\(Cl_2+2NaOH->NaCl+NaClO+H_2O\) (2)
theo (1) \(n_{Cl_2}=n_{MnO_2}=0,8\left(mol\right)\)
vì \(\frac{0,8}{1}< \frac{2}{2}\) => NaOH dư
theo (2) \(n_{NaOH\left(pư\right)}=2n_{Cl_2}=1,6\left(mol\right)\)
=> \(n_{NaOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\)
theo (2) \(n_{NaCl}=n_{Cl_2}=0,8\left(mol\right)\)
nồng độ mol của các chất trọng dung dịch sau phản ứng là
\(C_{M\left(NaCl\right)}=\frac{0,8}{0,5}=1,6M\)
\(C_{M\left(NaOH\right)dư}=\frac{0,4}{0,5}=0,8\left(mol\right)\)

\(n_{MnO_2}=0,8\left(mol\right)\)
\(PTHH:MnO_2+4HCl_{\left(\text{đ}\right)}\underrightarrow{t^o}MnCl_2+Cl_2+2H_2O\)
(mol)_____0,8_______________________0,8__________
\(n_{NaOH}=2\left(mol\right)\)
\(PTHH:2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
(mol)____1,6_______0,8______0,8____0,8___________
Tỉ lệ: \(\frac{2}{2}>\frac{0,8}{1}\rightarrow\) NaOH dư 2 - 1,6 = 0,4 (mol)
\(C_{M_{NaOH}}=\frac{0,4}{0,5}=0,8\left(M\right)\)
\(C_{M_{NaCl}}=C_{M_{NaClO}}=\frac{0,8}{0,5}=1,6\left(M\right)\)
\(\sum C_M=0,8+1,6=2,4\left(M\right)\)

3)Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g
1)
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol. 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = CM(MnCl2) = CM(NaClO) = 0,8 /0,5 = 1,6 mol/l
CM(NaOH)dư = (2. 1,6)/0,5 = 0,8 mol/l