Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
n Fe = 0 , 12 ; n HNO 3 = 0 , 4
Tương tự như Câu 6, trong dung dịch X, gọi
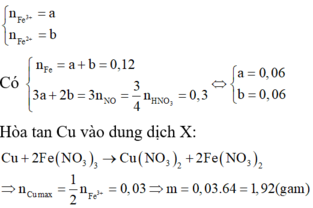

FeS2 0,14 mol. Fe3O4 = 0,06 mol. HNO3 0,8 mol. H2SO4 0,4 mol
=> Quy đổi: Fe = 0,14 + 0,06.3 = 0,32 mol. S = 0,14.2 = 0,28 mol. O = 0,06.4 = 0,24 mol
- Bảo toàn e: 0,32.3 + 0,28.6 - 0,24.2 = 3nNO
=> nNO = 0,72 mol => Bảo toàn ni tơ: trong dd có NO3- = 0,8 - 0,72 = 0,08 mol.
Mặt khác: Fe3+ = 0,32 mol. SO42- = 0,28 + 0,4 = 0,68 mol. => H+ dư = 0,68.2 + 0,08 - 0,32.3 = 0,48 mol.
=> 3Cu + 8H+ + 2NO3- ----> 3Cu2+ + 2NO + 4H2O
0,12 <----------- 0,08 mol
Cu + 2Fe3+ ---> Cu2+ + 2Fe2+
0,16<---- 0,32 mol
Vậy mCu cần dùng = (0,12 + 0,16).64 = 17,92g

Đáp án A
nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
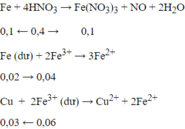
→ mCu = 0,03.64 = 1,92 gam

Đáp án A
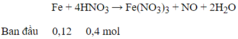
→ HNO3 hết , sau phản ứng có : Fe(NO3)3 0,1 mol ; Fe dư : 0,02 mol
Lượng Cu tối đa đuợc hoà tan hết là khi nó tham gia cả hai phản ứng :
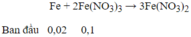
→ Sau phản ứng Fe(NO3)3 dư : 0,1 – 0,04 = 0,06 mol
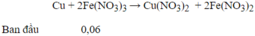
→ Số mol Cu tối đa được hoà tan là : 0,03 mol → m Cu = 0,03.64 = 1,92 gam

Mình ko phải giáo viên đâu!!!!
Đối với những bài có quá nhiều chất cậu nên quy ước về các nguyên tố rồi áp dụng bảo toàn e là đơn giản nhất!!!![]()
Bài giải:
Fe \(\rightarrow\) Fe+3 + 3e 4H+ + NO3- + 3e => NO +2 H2O
Gọi n Fe= a mol ta có: nNO => nH+ (trong ax) =>nH+ =0,12+0,05 = 0,17 mol
dễ nhận thấy: nH+ (dư) + 3nFe = nNaOH => (0,17-4a) + 3a = 0,13 => a=0,04 mol
=> dd Y có : 0,04 mol Fe3+ và 0,01 mol H+ (dư)
khi cho Cu vào Y thì có các PƯ sau:
Fe3+ + 1e => Fe2+ ; Cu => Cu2+ + 2e ; 4H+ + NO3- + 3e => NO + 2 H2O
áp dụng định luật bảo toàn e ta có: 0,04 + \(\frac{3}{4}\) 0,01 = 0,0475 mol (e nhường) => nCu=0,02375 mol
Vậy m Cu=0,02375.64= 1,52 (g)
bài này nhiều chỗ mình trình bày chưa chặt chẽ mong các bạn và thầy cô đóng góp ý kiến!!!!!!!


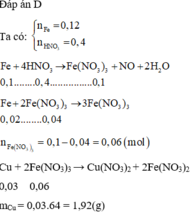
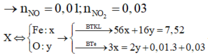
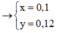
24gam