Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tóm tắt: 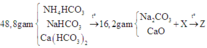
Gọi a; b; c lần lượt là số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2
Ta có: 89a + 84b + 162c =48,8 (l)
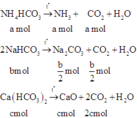
Khối lượng của hỗn hợp rắn là: 53b + 56c = 16,2 (2)
Hỗn hợp khí X gồm NH3 (a mol) và CO2 (a + b 2 + 2c)
⇒ n x = (2a + b 2 + 2c)
Khi X ở nhiệt độ 180 – 200°C, dưới áp suất khoảng 200 atm thì đây chính là phản ứng điều chế đạm urê nên ta có phản ứng:
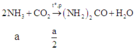
NH3 phản ứng với CO2 theo tỉ lệ 1:2 lượng khí Z còn lại chính là CO2 ⇒ n z = a 2 + b 2 . 2 c
Do sau phản ứng đưa về nhiệt độ ban đầu nên ta có:
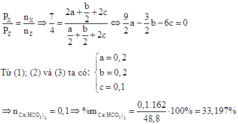
Đáp án A.

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 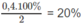
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

Dựa vào nguyên lý Le Chatelier ta xét các thay đổi cân bằng:
(a) Khi tăng nhiệt độ → thì cân bằng sẽ chuyển dịch theo chiều giảm nhiệt độ tức là chiều thu nhiệt (chiều thuận).
(b) Khi thêm một lượng hơi nước → thì cân bằng sẽ chuyển dịch theo chiều giảm hơi nước tức là chiều nghịch.
(c) Khi tăng áp suất chung của hệ thì cân bằng không bị chuyển dịch do số mol khí ở trước và sau phản ứng bằng nhau.
(d) Khi dùng chất xúc tác thì cân bằng không bị chuyển dịch mà chỉ làm cho phản ứng nhanh đạt trạng thái cân bằng tức là chỉ thay đổi tốc độ phản ứng.
(e) Khi thêm một lượng CO2 → Cân bằng sẽ chuyển dịch theo chiều giảm CO2 tức là chiều thuận.
Chọn đáp án B