K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

27 tháng 11 2016
nC=nCO2=0,672:22,4=0,03
=> mC=0,03.12=0,36 g
=> %C=60%
nH2O=2.nH=2.0,72/18=0,08
=< mH=0,08
=> %H=13,3%
=> %O=100-13.3-60=26,7%

2 tháng 11 2016
a) \(4P+5O_2\rightarrow2P_2O_5\)
b) \(4H_2+Fe_3O_4\rightarrow3Fe+4H_2O\)
c) \(4Ca+6H_3PO_4\rightarrow2Ca_2\left(PO_4\right)_3+9H_2\)
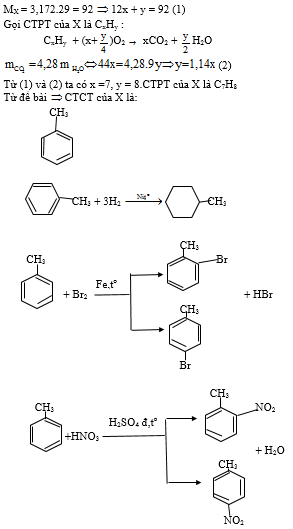

Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)