Cho một thanh sắt và một viên kẽm vào cốc chứa 150ml dung dịch CuSO4. Sau một thời gian, lấy hai thanh kim loại ra khỏi cốc, thu được dung dịch M trong đó nồng độ mol của muối kẽm gấp 2,5 lần của muối sắt. Thêm dung dịch NaOH dư vào dung dịch M, lọc lấy kết tủa rồi nung ngoài không khí đến khối lượng không đổi, thu được 20g chất rắn N. Cho dòng khí H2 đi qua N đốt nóng tới khi phản ứng hoàn toàn, thu được 15,84g chất rắn P. Tính nồng độ mol/lit của dung dịch CuSO4 ban đầu và số gam đồng bám trên mỗi thanh kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

n ZnSO4 = 2,5 n FeSO4 Zn+CuSO4−−>ZnSO4+Cu 2,5x------------------------------------2,5x Fe+CuSO4−−>FeSO4+Cu x---------------------------------------x m dung dịch giảm = m 2 kim loại tăng = 0,22 (g) Hay 160x + 64x - 162,5x - 56x = 5,5x = 0,22 (g) --> x = 0,04 (mol) m Cu trên Zn = 6,5 (g) m Cu trên Fe = 2,56 (g) Ở pứ tiếp theo cho vào NaOH dư : ZnSO4+2NaOH−−>Zn(OH)2+Na2SO4 FeSO4+2NaOH−−>Fe(OH)2+Na2SO4 0,04-----------------------------0,04 Zn(OH)2+2NaOH−−>Na2ZnO2+2H2O Trong kết tủa chắc chắn có Fe(OH)2 và có thể có thể có Cu(OH)2 TH1 : Tạo ra 1 kết tủa : Fe(OH)2 2Fe(OH)2+(1/2)O2−−>Fe2O3+2H2O 0,04 -------------------------------0,02 Rõ ràng m Fe2O3 = 3,2 (g) < m rắn theo đề bài ==> Loại TH2 : Tạo 2 kết tủa CuSO4+2NaOH−−>Cu(OH)2+Na2SO4 0,145-----------------------------0,145 2Fe(OH)2+(1/2)O2−−>Fe2O3+2H2O 0,04------------------------------------0,02 Cu(OH)2−−>CuO+H2O 0,145--------------0,145 --> m Fe2O3 = 3,2 (g) --> m CuO = 11,6 (g) --> n CuO = 0,145 (mol) n CuSO4 ban đầu = 0,145 + 0,04.2,5 + 0,04 = 0,285 (mol) --> C m CuSO4 = 0,285/0,5 = 0,57 M

1.
M + CuSO4 -> MSO4 + Cu (1)
nCuSO4 ban đầu=0,5.0,2=0,1(mol)
nCuSO4 sau PƯ=0,5.0,1=0,05(mol)
nCuSO4 bị PƯ=0,1-0,05=0,05(mol)
Theo PTHH 1 ta có:
nM=nCu=nCuSO4 bị PƯ=0,05(mol)
mCu sinh ra=64.0,05=3,2(g)
Ta có:
mCu-mM=0,4
=>mM=3,2-0,4=2,8(g)
MM=\(\dfrac{2,8}{0,05}=56\)
Vậy M là sắt,KHHH là Fe
Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag (2)
Fe + Cu(NO3)2 -> Fe(NO3)2 + Cu (3)
nAgNO3=0,1(mol)
nCu(NO3)2=0,1(mol)
Theo PTHH 2 ta có:
nAg=nAgNO3=0,1(mol)
mAg=108.0,1=10,8(g)
Vì 10,8<15,28 nên phải có PƯ 3
mCu=15,28-10,8=4,48(g)
nCu=0,07(mol)
Vì 0,07<0,1 nên sau PƯ 3 xảy ra thì Cu(NO3)2 dư
Theo PTHH 2 và 3 ta có:
nFe(2)=\(\dfrac{1}{2}\)nAg=0,05(mol)
nFe(3)=nCu=0,07(mol)
=>mFe=(0,05+0,07).56=6,72(g)

Gọi a là số gam Zn tham gia phản ứng ở phương trình :
Zn + CuSO4 \(\rightarrow\) ZnSO4 + Cu ( 1 )
Theo phương trình , ta có : \(n_{Zn}=\dfrac{a}{56}=n_{ZnSO_4}=n_{Cu}\)
Số gam Zn còn dư : 50 - 65 \(\cdot\dfrac{a}{65}+64\cdot\dfrac{a}{65}=50-0,3=49,7\left(g\right)\)
Giải ra , ta được a = 19,5 ( gam ) \(\Rightarrow n_{Zn}=n_{ZnSO_4}=n_{Cu}=0,3\left(mol\right)\)
Gọi b là số gam Zn sau phản ứng ở phương trình :
Zn + 2AgNO3 \(\rightarrow\) Zn(NO3)2 + 2Ag ( 2 )
Vì thể tích dung dịch AgNO3 gấp 3 lần thể tích của dung dịch CuSO4 . Do vậy số mol của AgNO3 sẽ gấp 3 lần số mol của CuSO4 và bằng 0,3 . 3 = 0,9 ( mol ) . Ta có :
b = 70 - 65 . 0,9 + 2 . 0,9 . 108 = 205,9 ( gam )
Vậy khối lượng miếng Zn thứ hai tăng : 205,9 - 70 = 135,9 ( gam )

Đáp án D
A → An+
nFe + 2An+ → nFe2+ + 2A
2,2A/n - 5,6 = 12 -11,2 = 0,8→ A = 32n→A = 64 (Cu)
CM = 12,8/(64.0,4) = 0,5M

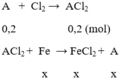
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 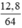 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 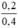 = 0,5M
= 0,5M
Dung dịch M gồm : FeSO4 ,ZnSO4 và CuSO4 dư
Kết tủa gồm : Fe(OH)2 , Cu(OH)2 (Không còn Zn(OH)2 vì NaOH dư nên bị hòa tan hết).
Chất rắn N : Fe2O3(a mol) ; CuO(b mol)
\(\Rightarrow 160a + 80b = 20(1)\)
Chất rắn P :
Fe : \(n_{Fe} = 2n_{Fe_2O_3} = 2a(mol)\)
Cu : \(n_{Cu} = n_{CuO} = b(mol)\)
\(\Rightarrow 112a + 64b = 15,84(2)\)
Từ (1)(2) suy ra a = 0,01 ; b = 0,23
Bảo toàn nguyên tố với Fe,Cu :
\(n_{FeSO_4} = 2n_{Fe_2O_3} = 0,02(mol)\\ n_{CuSO_4} = n_{CuO} = 0,23(mol)\)
\(n_{ZnSO_4} = 2,5n_{FeSO_4} = 0,05(mol)\)
Zn + CuSO4 \(\to\) ZnSO4 + Cu
..0,05...0,05......................0,05.........(mol)
Trên thanh kẽm : \(m_{Cu} = 0,05.64 = 3,2(gam)\)
Fe + CuSO4 \(\to\) FeSO4 + Cu
0,02....0,02......................0,02.......(mol)
Trên thanh sắt : \(m_{Cu} = 0,02.64 = 1,28(gam)\)
\(n_{CuSO_4} = 0,05 + 0,02 + 0,23= 0,3(mol)\\ \Rightarrow C_{M_{CuSO_4}} = \dfrac{0,3}{0,15} = 2M\)
..