Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đồng nhất dữ kiện các phần để tiện tính toán, bằng cách nhân khối lượng Br2 với 2. Bình H2SO4 đặc hấp thụ H2O, bình KOH đặc hấp thụ CO2. Khối lượng bình tăng chính là khối lượng khí hoặc hơi mà bình đó hấp thụ
Vì bay hơi chỉ có nước, mà A tác dụng được với NaOH nên A chỉ chứa gốc phenol hoặc gốc cacboxylic (–COOH).
BTKL:
mY + mO2 = mCO2 + mNa2CO3 + mH2O => mO2 = 12,8g => nO2 = 0,4mol
BTNT O: nO(Y) + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
=> nO(Y) = 0,4
=> nC : nH: nO: nNa = 0,4 : 0,6 : 0,4 : 0,2 = 2:3:2:1
=> C2H3O2Na => A: C2H4O2
(Vì A chứa gốc phenol (–OH) hoặc axit (–COOH) nên 1Na sẽ thế 1H).

a. Phương trình phản ứng :
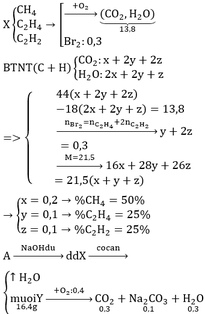
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
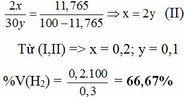
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.

Ta có :
\(m_{hỗn\ hợp} = n.M = \dfrac{2,24}{22,4}.2.7,56 = 1,521(gam)\)
Bảo toàn khối lượng , sau khi nung : m = 1,521(gam)
\(\Rightarrow n_{hỗn\ hợp\ sau} = \dfrac{1,521}{2.8,4} = 0,09(mol)\)
Ta có :
\(\dfrac{p_{trước}}{p_{sau}} = \dfrac{n_{trước}}{n_{sau}}\)
⇔ \(\dfrac{1}{p_{sau}} = \dfrac{0,1}{0,09}\\ \Rightarrow p_{sau} = 0,9\ atm\)

mtăng = mC2H4
=> \(n_{C_2H_4}=\dfrac{5,6}{28}=0,2\left(mol\right)\)
=> VC2H4 = 0,2.22,4 = 4,48 (l)
=> VCH4 = 6,72 - 4,48 = 2,24 (l)

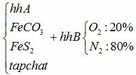
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
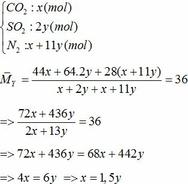
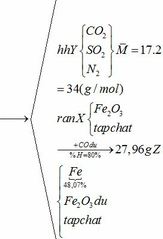
Khối lượng Fe có trong Z là:
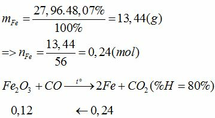
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
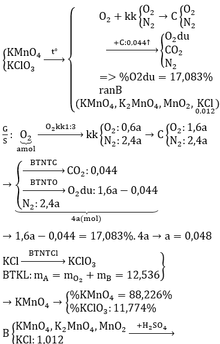
b) hỗn hợp Y gồm:
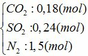
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
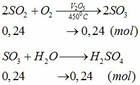
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
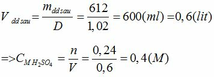
Ta có: 44nC3H8 + 58nC4H10 = 360 (1)
Mà: VC3H8:VC4H10 = 1:1
⇒ nC3H8 = nC4H10 (2)
Từ (1) và (2) \(n_{C_3H_8}=n_{C_4H_{10}}=\dfrac{60}{17}\left(mol\right)\)
⇒ mC3H8 = 60/17.44 = 155,3 (g)