Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
Ta có; \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,03\left(mol\right)\\n_{O_2}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03\cdot56=1,68\left(g\right)\\V_{O_2}=0,02\cdot22,4=0,448\left(l\right)\end{matrix}\right.\)

\(n_{C_2H_5OH}=\dfrac{23}{46}=0,5mol\)
\(C_2H_4+H_2O\rightarrow\left(t^o,H^+\right)C_2H_5OH\)
0,5 0,5 ( mol )
\(V_{C_2H_4}=0,5.22,4=11,2l\)

THAM KHẢO
Quy đổi hỗn hợp Fe và FexOy thành Fe và O.
Số mol của Fe và O là x và y.
Xét các quá trình :
Fe, O H2SO4đ,n−−−−−−−−→H2SO4đ,n→ Fe3+, O2-, S+4(SO2) Cu−→Cu→ Fe2+, Cu2+
(Đối với PP bảo toàn e thì chỉ xét số oxi của nguyên tố ở đầu và cuối quá trình)
Quá trình nhường eQuá trình nhận e
Fe -> Fe2+ + 2e
x=--2x
Cu -> Cu2+ + 2e
0,055=0,11
O +2e -> O2-
y-.2y
S+6 +2e -> S+4
--0,07..0,035
Vì ne nhường =ne nhận <=> 2x+0,11=2y+0,07 (1)
Khối lượng Fe + O = khối lượng Fe + FexOy = 1,12 + 9,28=10,4
=> 56x + 16y =10,4 (2)
Giải hệ pt (1) và (2) => x=0,14; y=0,16
Ta có nFe (Fe ban đầu)=1,12/56=0,02
=> nFe(FexOy) = 0,12
=> xy=nFe(FexOy)/nO=0,12/0,16=3/4
=> oxit cần tìm là Fe3O4.

\(a/n_{Fe}=\dfrac{2,52}{56}=0,045mol\\ 3Fe+2O_2\xrightarrow[]{t^0}Fe_3O_4\\ n_{O_2}=\dfrac{0,045.2}{3}=0,03mol\\ V_{O_2}=0,03.22,4=0,672l\\ b/2KClO_3\xrightarrow[]{t^0}2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,03.2}{3}=0,02mol\\ m_{KClO_3}=0,02.122,5=2,45g\)

C2H2+2Br2->C2H2Br4
0,05-----0,1
n Br2=\(\dfrac{16}{160}\)=0,1 mol
=>VC2H2=0,05.22,4=1,12l
CaC2+2H2O->Ca(OH)2+C2H2
0,05------------------------------0,05
=>m CaC2=0,05.64=3,2g
\(n_{Br_2}=\dfrac{16}{160}=0,1mol\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,05 0,1 ( mol )
\(V_{C_2H_2}=0,05.22,4=1,12l\)
\(CaC_2+2H_2O\rightarrow C_2H_2+Ca\left(OH\right)_2\)
0,05 0,05 ( mol )
\(m_{CaC_2}=0,05.64=3,2g\)

a)
\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(n_{O_2}=\dfrac{3}{2}\cdot0.2=0.3\left(mol\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_{O_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.2...............................................0.1\)
\(n_{KMnO_4\left(bđ\right)}=\dfrac{0.2}{90\%}=\dfrac{2}{9}\left(mol\right)\)
\(m_{KMnO_4}=\dfrac{2}{9}\cdot158=35.11\left(g\right)\)
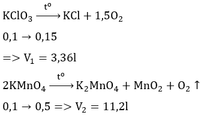

Chọn B