Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{dd_{CuSO_4}}=a\left(g\right)\)
\(\Rightarrow m_{CuSO_4}=0.08a\left(g\right)\)
\(m_{CuSO_4\cdot5H_2O}=b\left(g\right)\)
\(\Rightarrow m_{CuSO_4}=\dfrac{b}{250}\cdot160=0.64b\left(g\right)\)
\(m_{dd_{CuSO_4\left(15\%\right)}}=a+b=560\left(g\right)\left(1\right)\)
\(m_{CuSO_4\left(15\%\right)}=0.08a+0.64b=560\cdot16\%=89.6\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=480,b=80\)

Khối lượng NaOH có trong dung dịch ban đầu:
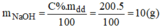
Gọi x(g) là khối lượng dung dịch NaOH 10% cần dùng:
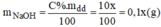
Đề thu được dung dịch 8% ta có:
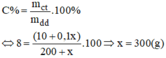
Vậy phải trộn thêm 300g dung dịch NaOH 10% ta sẽ có 500(g) dung dịch NaOH nồng độ 8%.

mCuSO4=16%.500= 80(g)
Gọi x,y là KL dd CuSO4 8% và tinh thế CuSO4.5H2O cần lấy (x>0)
m(CuSO4)= 0,08x+ 16/25y
<=>0,08x+ 0,64y= 80 (1)
Mặt khác vì KL dung dịch CuSO4 16% là 500 gam nên: x+y=500 (2)
Từ (1), (2) ta có hpt:
\(\left\{{}\begin{matrix}0,08x+0,64y=80\\x+y=500\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3000}{7}\\y=\dfrac{500}{7}\end{matrix}\right.\)
Vậy để pha chế 500 gam dd CuSO4 16% thì cần 3000/7 (g) dd CuSO4 8% và 500/7 (g) tinh thể CuSO4.5H2O.

mNaOH=100.5%=5g
Gọi mddNaOH thêm =x(g)
=>mNaOH=0,2x
Tổng mNaOH=0,2x+5
Tổng mdd=x+100
=>0,2x+5=(x+100)0,1
=>0,1x=5=>x=50g

250g dd A ,C%=6%------------8%-----------10-8
Xg dd NaOh , C% =10%-------8%-----------8-6
=> \(\dfrac{250}{X}\)= 1
=> X = 250 (g)
b) mA=\(\dfrac{250.6}{100}\)=15(g)
Gọi a là số gam NaOH thêm vào
Ta có :
C%=\(\dfrac{\left(15+a\right).100\%}{250+a}\)= 8%
=> 1500 + 100a = 2000 + 8a
=> 92a = 500
=> a=\(\dfrac{500}{92}\)= 5,4(g)
c) Gọi b là khối lượng nước bay hơi
Ta có :
C% =\(\dfrac{15.100\%}{250-b}\)= 8%
=> 1500 =2000 - 8b
=> 8b = 500
=> b = \(\dfrac{500}{8}\)= 62,5(g)
theo giả thiết, mNaOH = 250 0,06 = 15 (g)
a)
gọi khối lượng NaOH thêm vào là a (g) => khối lượng dung dịch NaOH 10% là 10a (g)
để được dung dịch như đề bài thì: \(\dfrac{15+a}{250+10a}=0,08\Rightarrow a=25\left(g\right)\)
Vậy cần trộn thêm 250 g dung dịch NaOH 10% để được dung dịch NaOH 8%
b)
gọi khối lượng NaOH thêm vào là a (g)
để được dung dịch như đề bài thì: \(\dfrac{15+a}{250}=0,08\Rightarrow a=5\left(g\right)\)
Vậy cần trộn thêm 5 g NaOH để được dung dịch NaOH 8%
c)
gọi khối lượng nước bay hơi là a (g)
để được dung dịch như đề bài thì: \(\dfrac{15}{250-a}=0,08\Rightarrow a=62,5\left(g\right)\)
Vậy cần làm bay hơi 62,5 g nước để được dung dịch NaOH 8%

\(m_{H_2SO_4}=9.8\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{9.8}{98}=0.1\left(mol\right)\)
\(Đặt:n_{Ba\left(1\right)}=a\left(mol\right)\)
\(Ba+H_2SO_4\rightarrow BaSO_4+H_2\)
\(0.1........0.1.........0.1.........0.1\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\left(1\right)\)
\(a..................a........a\)
\(m_{Ba\left(OH\right)_2}=171a\left(g\right)\)
\(m_{dd}=m_{Ba}+m_{ddH_2SO_4}-m_{H_2}-m_{BaSO_4}=\left(0.1+a\right)\cdot137+200-23.3-\left(0.1+a\right)\cdot2=190.2+136.8a\left(g\right)\)
\(C\%Ba\left(OH\right)_2=\dfrac{171a}{190.2+136.8a}\cdot100\%=2.51\%\)
\(\Leftrightarrow a=0.028\)
\(m_{Ba}=\left(0.1+0.028\right)\cdot137=17.536\left(g\right)\)
Số mình ra hơi lẻ chút ,hông biết đúng hay sai. Bạn xem thử nha

Gọi: a, b lần lượt là khối lượng dung dịch NaCl (4%) và NaCl (12%)
Ta có :
\(m_{dd_{NaCl\left(10\%\right)}}=a+b=100\left(g\right)\left(1\right)\)
\(m_{NaCl\left(10\%\right)}=100\cdot10\%=10\left(g\right)\)
\(m_{NaCl\left(4\%\right)}=0.04a\left(g\right)\)
\(m_{NaCl\left(12\%\right)}=0.12b\left(g\right)\)
\(\Rightarrow0.04a+0.12b=10\left(2\right)\)
\(\left(1\right),\left(2\right):a=25,b=75\)

Câu 6:
\(m_{dd.bđ}=1,1.200=220\left(g\right)\)
\(n_{FeSO_4.7H_2O}=\dfrac{83,4}{278}=0,3\left(mol\right)\Rightarrow n_{FeSO_4}=0,3\left(mol\right)\)
=> \(C\%_{dd.bđ}=\dfrac{0,3.152}{220}.100\%=20,73\%\)
Câu 7:
\(m_{MgCl_2\left(dd.ở.60^oC\right)}=\dfrac{500.37,5}{100}=187,5\left(g\right)\)
=> \(m_{H_2O}=500-187,5=312,5\left(g\right)\)
Giả sử có a mol MgCl2.6H2O tách ra
\(n_{MgCl_2\left(dd.ở.10^oC\right)}=\dfrac{187,5}{95}-a=\dfrac{75}{38}-a\left(mol\right)\)
=> \(m_{MgCl_2\left(dd.ở.10^oC\right)}=95\left(\dfrac{75}{38}-a\right)=187,5-95a\left(g\right)\)
\(n_{H_2O\left(tách.ra\right)}=6a\left(mol\right)\)
\(m_{H_2O\left(dd.ở.10^oC\right)}=312,5-18.6a\)=312,5 - 108a (g)
=> \(S_{10^oC}=\dfrac{187,5-95a}{312,5-108a}.100=53\left(g\right)\)
=> \(a=\dfrac{4375}{7552}\left(mol\right)\)
=> \(m_{MgCl_2.6H_2O}=\dfrac{4375}{7552}.203=117,6\left(g\right)\)

\(m_{CuSO_4}=a;m_{H_2O}=b\\ a+b=560\\ C\%_{ddsau}=\dfrac{0,28a}{560}=\dfrac{15}{100}\\ a=300;b=260\)
Vậy cần lấy 300 g dung dịch đồng(II) sulfate 28% pha với 260 g nước.
Gợi ý:
- Coi FeSO4 . 7H2O là 1 dung dịch
- Suy ra C%FeSO4 . 7H2O = \(\dfrac{m_{F\text{eS}O4}}{m_{F\text{eS}O4}+m_{H2\text{O}}}\cdot100\%=\dfrac{152}{152+126}\cdot100\%=54,676\%\)
- Áp dụng sơ đồ đường cheo về C% tính được tỉ lệ khơi lượng giữa FeSO4 . 7H2O và dung dịch FeSO4 16%
- Mặt khác, lại có tổng khối lượng của 2 dung dịch là 200 (gam)
- Từ đó tính được khối lượng mỗi dung dịch
=> Kết luận .....