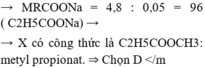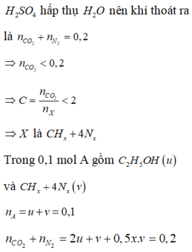Đốt cháy hoàn toàn 6.8 gam HCHC X thu đc sản phẩm gồm 4,48 lít khí CO2 ( đktc ) và 3,6 gam H2O
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải thích:
nCO2 = 0,2 mol ; nH2O = 0,2 mol
Bảo toàn nguyên tố : nC = 0,2 ; nH = 0,4
=> mX = mC + mH + mO => nO = 0,1 mol
=> nC : nH : nO = 0,2 : 0,4 : 0,1 = 2 : 4 : 1
Vì X + NaOH tạo muối axit hữu cơ => X là este
=> C4H8O2.
TQ : RCOOR’ + NaOH -> RCOONa + R’OH
Vì : mmuối > meste => MR’ < MNa = 23 => R’ là CH3-
Vậy este là : C2H5COOCH3 (metyl propionat)
Đáp án A

Giải thích:
nCO2 = 0,2 (mol) ; nH2O = 0,2 (mol) => este no, đơn chức
Gọi CTPT của este là CnH2nO2
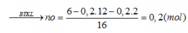
=> neste = 1/2 nO = 0,1 (mol)
=> Meste = 6/ 0,1 = 60
=> 14n + 32 = 60 => n = 2
Vậy CTPT của este là C2H4O2
Đáp án B

Đáp án : B
nC = nCO2 = 0,2 mol ; nH = 2nH2O = 0,4 mol
CÓ : mX = mC + mH + mO => nO = 0,2 mol
=> nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2 : 1
Vì X là este => số O chẵn
=> Nếu số O = 2 => C2H4O2

Sơ đồ X + O 2 → C O 2 + H 2 O ( 1 )
Áp dụng định luật bảo toàn khối lượng cho sơ đồ (1), ta có :
m + m O 2 = m C O 2 + m H 2 O
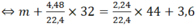
⇔ m = 1,6 gam

Ta có: \(n_{O_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Theo ĐLBT KL, có: mX + mO2 = mH2O + mCO2 + mN2.
⇒ 44nCO2 + 28nN2 = 8,9 + 0,375.32 - 6,3 = 14,6 (1)
Mà: \(n_{CO_2}+n_{N_2}=\dfrac{7,84}{22,4}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,3\left(mol\right)=n_C\\n_{N_2}=0,05\left(mol\right)\Rightarrow n_N=0,05.2=0,1\left(mol\right)\end{matrix}\right.\)
- Đốt cháy X thu CO2, H2O và N2 → X chứa C, H, N, có thể có O.
Ta có: \(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\Rightarrow n_H=0,35.2=0,7\left(mol\right)\)
⇒ mC + mH + mN = 0,3.12 + 0,7.1 + 0,1.14 = 5,7 (g) < 8,9 (g)
Vậy: X chứa C, H, O và N.
⇒ mO = 8,9 - 5,7 = 3,2 (g) \(\Rightarrow n_O=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTPT của X là CxHyOzNt.
\(\Rightarrow x:y:z:t=0,3:0,7:0,2:0,1=3:7:2:1\)
Vậy: CTĐGN của X là C3H7O2N.